分析:A分子式为C
4H
6O
5,不饱和度为
=2,A与醇(ROH)或羧酸(RCOOH)在浓H
2SO
4和加热条件下均可反应生成有香味的产物,则A含有羟基、羧基,1mol A与足量的金属钠反应产生1.5mol H
2,结合A的电离平衡常数,可知A为二元弱酸,则A分子中含有一个羟基和二个羧基,核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,则A的结构简式为:HOOCCH(OH)CH
2COOH,M在氢氧化钠水溶液、加热条件下发生水解反应得到A,故M为HOOCCH(Cl)CH
2COOH,A发生消去反应生成B为HOOCCH=CHCOOH,B与足量的NaOH反应生成D为NaOOCCH=CHCOONa,B与溴发生加成反应生成E为HOOCCH(Br)CH(Br)COOH,E在氢氧化钠醇溶液、加热条件下发生消去反应生成,再酸化得到F为HOOCC≡CCOOH,据此解答.
解答:
解:A分子式为C
4H
6O
5,不饱和度为
=2,A与醇(ROH)或羧酸(RCOOH)在浓H
2SO
4和加热条件下均可反应生成有香味的产物,则A含有羟基、羧基,1mol A与足量的金属钠反应产生1.5mol H
2,结合A的电离平衡常数,可知A为二元弱酸,则A分子中含有一个羟基和二个羧基,核磁共振氢谱表明A分子中有5种不同化学环境的氢原子,则A的结构简式为:HOOCCH(OH)CH
2COOH,M在氢氧化钠水溶液、加热条件下发生水解反应得到A,故M为HOOCCH(Cl)CH
2COOH,A发生消去反应生成B为HOOCCH=CHCOOH,B与足量的NaOH反应生成D为NaOOCCH=CHCOONa,B与溴发生加成反应生成E为HOOCCH(Br)CH(Br)COOH,E在氢氧化钠醇溶液、加热条件下发生消去反应生成,再酸化得到F为HOOCC≡CCOOH,
(1)由上述分析可知,根据化合物A的性质,A分子中含有一个羟基和二个羧基,故选;bc;
(2)由于上述分析可知,A为HOOCCH(OH)CH
2COOH,D为NaOOCCH=CHCOONa,F为HOOCC≡CCOOH,M为HOOCCH(Cl)CH
2COOH,
故答案为:HOOCCH(OH)CH
2COOH;NaOOCCH=CHCOONa;HOOCC≡CCOOH;HOOCCH(Cl)CH
2COOH;
(3)由上述分析可知,A→B属于消去反应; B→E属于加成反应,故答案为:消去反应;加成反应;
(4)M→A第①步卤代烃的水解反应反应,反应条件为:氢氧化钠水溶液、加热,
E→F第①步反应方程式为:HOOCCH(Br)CH(Br)COOH+4NaOH
NaOOCC≡CCOONa+2NaBr+4H
2O,
故答案为:氢氧化钠水溶液、加热;HOOCCH(Br)CH(Br)COOH+4NaOH
NaOOCC≡CCOONa+2NaBr+4H
2O;
(5)在催化剂作用下,HOOCCH=CHCOOH与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.该反应的化学方程式为:n

+n HOCH
2CH
2OH

+(2n-1)H
2O,
故答案为:n

+n HOCH
2CH
2OH

+(2n-1)H
2O;
(6)与A具有相同官能团的A的同分异构体有:

,
故答案为:

.


 +n HOCH2CH2OH
+n HOCH2CH2OH +(2n-1)H2O,
+(2n-1)H2O, +n HOCH2CH2OH
+n HOCH2CH2OH +(2n-1)H2O;
+(2n-1)H2O; ,
, .
.




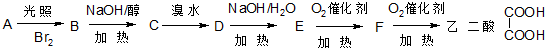
 Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上.
Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上.