
解析:本题可分3种情况讨论:(1)氨水电离产生![]() 、OH-;(2)
、OH-;(2)![]() 水解产生H+及剩余
水解产生H+及剩余![]() ;(3)
;(3)![]() 水解受到影响,促进或抑制。在分析时要注意两点:氨水电离程度不很大,
水解受到影响,促进或抑制。在分析时要注意两点:氨水电离程度不很大,![]() 水解程度也不很大。另外,NH4HSO4溶液,H+抑制
水解程度也不很大。另外,NH4HSO4溶液,H+抑制![]() 水解,而NH4HCO3中,
水解,而NH4HCO3中,![]() 比氨水更弱,
比氨水更弱,![]() 水解呈碱性,会促进
水解呈碱性,会促进![]() 水解,但影响不很大,(NH4)2SO4溶液中,
水解,但影响不很大,(NH4)2SO4溶液中,![]() 的浓度最大。所以,
的浓度最大。所以,![]() 的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH4HCO3、NH3·H2O,其pH可根据
的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH4HCO3、NH3·H2O,其pH可根据![]() 水解程度及电离的情况得出pH由大到小的顺序是NH3·H2O、NH4HCO3、NH4Cl、(NH4)2SO4、NH4HSO4。
水解程度及电离的情况得出pH由大到小的顺序是NH3·H2O、NH4HCO3、NH4Cl、(NH4)2SO4、NH4HSO4。
答案:⑤>④>②>③>①
①>③>②>⑤>④


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
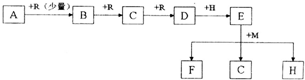
| ||
| ||
| ||
| ||
| 20V |
| 7 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
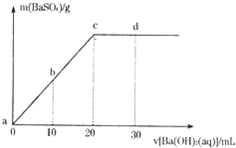 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )| A、溶液的导电能力:a>b>c>d | B、溶液的pH:a<b<c<d | C、c点溶液和d点溶液均呈碱性 | D、b点溶液中c(H+)和d点溶液中c(OH-)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com