
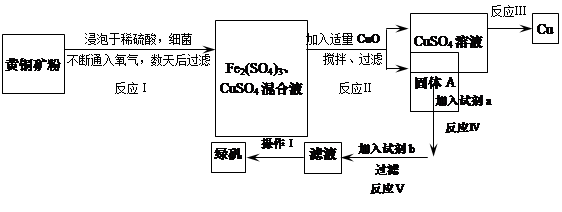
| | Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
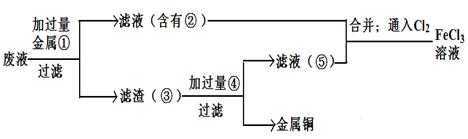
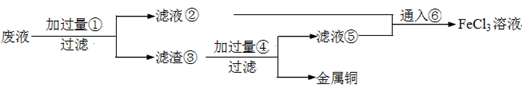
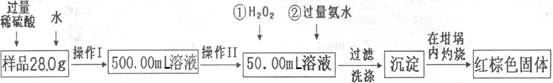
 Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。 2Cu+O2+2H2SO4.或Fe+CuSO4=Cu+FeSO4
2Cu+O2+2H2SO4.或Fe+CuSO4=Cu+FeSO4 Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。 2Cu+O2↑+2H2SO4.或Fe+CuSO4=Cu+FeSO4
2Cu+O2↑+2H2SO4.或Fe+CuSO4=Cu+FeSO4

科目:高中化学 来源:不详 题型:实验题
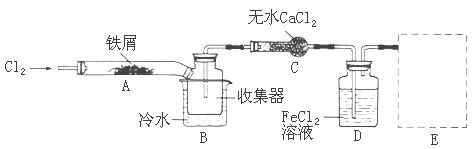
| A.氢氧化钠溶液 | B.酸性高锰酸钾溶液 | C.硫氰化钾溶液 | D.氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
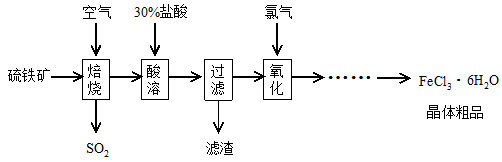
 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
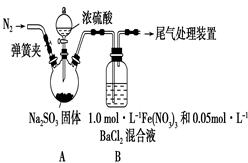
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只含Cu2+、Fe2+、Zn2+ | B.只含Zn2+ |
| C.只含Fe2+、Zn2+ | D.只含Cu2+、Fe3+、Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
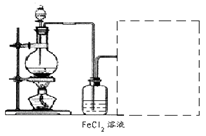
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.50mL量筒 | B.100mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com