
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他条件不变,向平衡体系中再充入0.32mol A,再达平衡时,B的转化率增大 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入各0.64mol A和B,平衡时n(C)<0.48mol | |
| D. | 反应前2 min的平均速率v(C)=0.004 mol•(L•min)-1 |
分析 A.再充入A,平衡正向移动;
B.降低温度正、逆反应速率都减小,正反应为放热反应,平衡正向移动;
C.反应其它气体分子数目不变,与原平衡为等效平衡,平衡时B的转化率相等,结合方程式计算;
D.计算生成C的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(C).
解答 解:A.再充入A,平衡正向移动,到达新平衡后B的转化率增大,故A正确;
B.降低温度正、逆反应速率都减小,正反应为放热反应,逆反应速率减小更多,平衡正向移动,则反应达到新平衡前v (逆)<v (正),故B错误;
C.反应其它气体分子数目不变,与原平衡为等效平衡,平衡时B的转化率相等,则平衡时参加反应的B为(0.32-0.2)mol×$\frac{0.64mol}{0.32mol}$=0.24mol,故平衡时n(C)=0.48mol,故C错误;
D.前2min内生成C的物质的量为(0.32-0.24)mol×2=0.16mol,则v(C)=$\frac{\frac{0.16mol}{10L}}{2min}$=0.008 mol•(L•min)-1,故D错误.
故选:A.
点评 本题考查化学平衡计算、化学反应速率、化学平衡移动等,C中注意对等效平衡规律的理解,也可以利用平衡常数计算,但相对比较麻烦.


科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液具有漂白性是因为空气中的CO2与消毒液中的NaClO反应生成HClO | |
| B. | “乙醇汽油”是向汽油中添加了一定比例的乙醇,该混合燃料的热值也发生了改变 | |
| C. | 用聚乳酸塑料代替聚乙烯塑料可减少白色污染 | |
| D. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 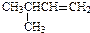 2-甲基-3-丁烯 2-甲基-3-丁烯 | B. | 乙炔的结构简式:CHCH | ||
| C. | 乙醚的分子式:C 2H 6O | D. | 甲基的电子式: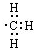 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中一定不存在共价键 | |
| B. | 气态物质中一定有共价键 | |
| C. | 在共价化合物中一定有共价键 | |
| D. | 由非金属元素组成的化合物中,一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| B. | 0.1 mol F- 中含有的电子数等于0.9×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 电解饱和食盐水若产生2 g氢气,则转移的电子数目为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 D>C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏日的傍晚常常看到万丈霞光穿云而过,美不胜收 | |
| B. | 食品加工厂利用豆浆中加入盐卤做豆腐 | |
| C. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 某化工厂利用静电除尘技术去除废气中的固体悬浮物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com