
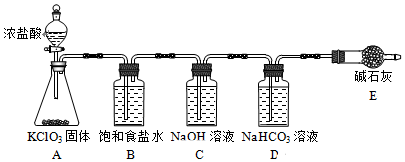
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
分析 装置A中氯酸钾固体和浓盐酸反应生成氯气,氯气中含氯化氢气体,通过装置B中饱和食盐水除去氯化氢,通过装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,通过碳酸氢钠溶液,氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大,最后通过碱石灰吸收多余氯气,
(1)①装置A中氯酸钾固体和浓盐酸反应生成氯气;
②B瓶溶液滴加紫色石蕊溶液变红色,说明含氢离子,是氯气中所含氯化氢生成;
③通过装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠;
④D瓶溶液中石蕊立即褪色的原因是氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大;
(2)①取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,次氯酸钠在酸溶液中氧化碘化钾生成碘单质,次氯酸见光分解;
②ClO-+2I-+2H+=I2+Cl-+H2O、I2+2S2O32-═2I-+S4O62-,ClO-~I2~2S2O32-,计算得到C瓶溶液中NaClO的含量.
解答 解:装置A中氯酸钾固体和浓盐酸反应生成氯气,氯气中含氯化氢气体,通过装置B中饱和食盐水除去氯化氢,通过装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,通过碳酸氢钠溶液,氯气和水反应生成的盐酸和碳酸氢钠反应,促进氯气和水反应正向进行次氯酸浓度增大,最后通过碱石灰吸收多余氯气,
(1)①装置A中氯酸钾固体和浓盐酸反应生成氯气,反应的化学方程式为KClO3+6HCl=3Cl2↑+KCl+3H2O,
故答案为:KClO3+6HCl=3Cl2↑+KCl+3H2O;
②B瓶溶液滴加紫色石蕊溶液变红色,说明含氢离子,B瓶溶液中H+的主要来源是氯气中所含氯化氢,
故答案为:氯气中混有氯化氢;
③氯气和装置C中氢氧化钠溶液反应生成氯化钠、次氯酸钠,C瓶溶液的溶质是NaClO、NaCl、NaOH,
故答案为:NaClO、NaCl、NaOH;
④D瓶溶液中石蕊立即褪色的原因是:溶液中存在平衡Cl2+H2O?HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大,
故答案为:溶液中存在平衡Cl2+H2O?HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大;
(2)①步骤Ⅰ总反应是次氯酸钠在酸溶液中氧化碘化钾生成碘单质,反应的离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,盖紧瓶塞并在暗处反应的原因是防止HClO分解,
故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;防止HClO分解;
②ClO-+2I-+2H+=I2+Cl-+H2O,I2+2S2O32-═2I-+S4O62-,
NaClO~I2~2S2O32-,
1 2
n 0.1000mol•L-1×0.020L
n=0.001mol,
C瓶溶液中NaClO的含量=$\frac{0.001mol×74.5g/mol}{0.020L}$=3.7g/L,
故答案为:3.7.
点评 本题考查了物质制备、物质性质、实验现象的垃圾应用、主要是物质特征性质和定量关系的计算分析,掌握基础是解题关键,题目难度中等.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:选择题

| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
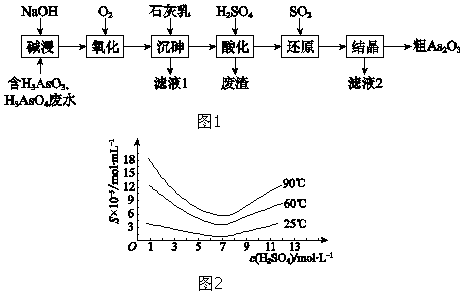
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径的大小顺序:rX>rY>rZ>rW | |
| B. | 元素Q和Z能形成QZ2型的共价化合物 | |
| C. | Z元素氢化物的沸点高于W元素氢化物的沸点 | |
| D. | X、Y、Z最高价氧化物的水化物之间两两不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和2:1的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al无剩余 | B. | 有白色沉淀生成 | ||
| C. | 所得气体全部为氢气 | D. | Na的物质的量是0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多 | |
| B. | C与D的最高价氧化物对应的水化物的碱性相比,后者更强 | |
| C. | 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高 | |
| D. | 简单离子半径:B<C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com