
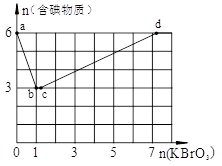
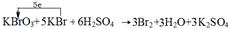 (2分)
(2分)

科目:高中化学 来源:不详 题型:填空题
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 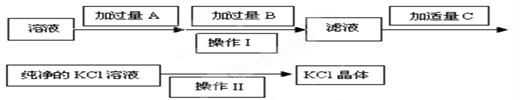
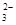 、OH-、HCO
、OH-、HCO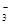 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
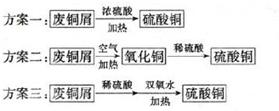
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
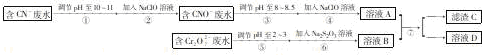
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCO3- | B.SO42- | C.SO32- | D.OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
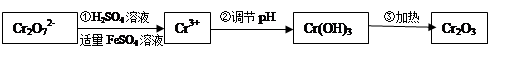
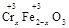 ·y
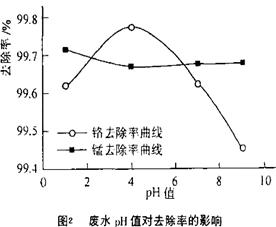
·y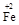 O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(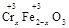 ·y
·y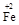 O)化学式是 。
O)化学式是 。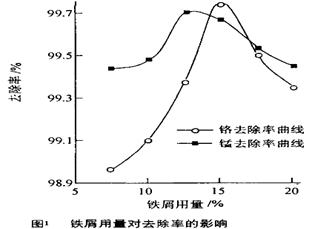
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.用分液的方法分离水和汽油的混合物 |
| B.用过滤的方法分离饱和食盐水与沙子的混合物。 |
| C.蒸馏时,应使温度计水银球插入液面以下 |
| D.蒸发结晶时应将溶液蒸干后再停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com