
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
【答案】Cl2、H+ Cl2 氧化性、酸性 酸性 既有氧化性又有还原性 MnO4- HBr 40.5 还原性、酸性
【解析】
(1)根据元素的化合价和物质的性质分析;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应;
③2HCl![]() H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(4)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算。
(1)在Cl2、Cl-、H+中,氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2,故答案为:Cl2、H+;Cl2;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低,则体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;故答案为:酸性;
③2HCl![]() H2↑+Cl2↑,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化性、还原性,故答案为:既有氧化性又有还原性;
H2↑+Cl2↑,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化性、还原性,故答案为:既有氧化性又有还原性;
(3)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),Cl2表现氧化性,而在盐酸中生成浅绿色溶液(FeCl2),H+具有氧化性,且氧化性Cl2>H+;浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2),则证明氧化性是MnO4->Cl2,所以氧化性顺序是:MnO4->Cl2>H+,所以氧化性最强的是MnO4-,故答案为:MnO4-
(4)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,且做还原剂的只占参加反应的HBr的![]() ;
;
设:消耗15.8 g氧化剂,则被氧化的还原剂的质量是x
2KMnO4 +16HBr═5Br2+2MnBr2+2KBr+8H2O
158×2 81×16×![]()
15.8g x 解得:x=![]() =40.5g
=40.5g
反应中HBr被氧化为Br2,HBr表现还原性;有MnBr2、KBr(盐)生成,HBr表现出了酸性;
故答案为:HBr;40.5;还原性、酸性。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】氨是重要的氮肥,合成原理为: N2(g)+3H2(g)![]() 2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:

(1)10 min内以NH3表示的平均反应速率:______;
(2)在10 ~20 min内:NH3浓度变化的原因可能是______________
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的平衡常数K1 = _________________(带数据的表达式),第2次平衡时NH3的体积分数=___________(小数点后保留一位);
(4)在反应进行至25 min时:①曲线发生变化的原因______________,② 达第二次平衡时,新平衡的平衡常数K2 ____ K1(填“大于”“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是研究铁钉腐蚀的装置图,下列说法不正确的是
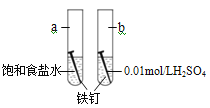
A. 铁钉在两处的腐蚀速率:a < b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


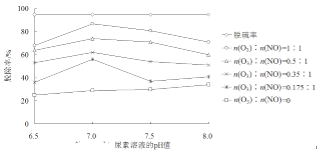
(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳

(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 自然界中正常的雨水呈酸性:H2O+CO2![]() H2CO3 ,H2CO3
H2CO3 ,H2CO3![]() H++HCO3—
H++HCO3—
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色)![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)氯原子的结构示意图_____;工业上利用电解饱和食盐水来获得氯气,其化学方程式为_____。
(2)将氯气通入石灰乳中可制取漂白粉,化学方程式为_____。漂白粉溶于水后,和空气中的二氧化碳作用,所得的溶液可用于漂白这是利用生成的 HClO,而该溶液长时间放置又会失去漂白能力,所涉及的化学反应方程式为_____。
(3)向盛有 KI 溶液的试管中加入少许 CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4 层会逐渐变浅,最后变成无色。
完成下列填空:
(a)写出并配平 CCl4层由紫色变成无色的化学反应方程式,并用“单线桥”标出电子转移的方向和数目。_____________
_____+_____+_____→_____HIO3+_____该反应中,_____元素的化合价升高。
(b)把 KI 换成 KBr,则 CCl4层变为_____色,继续滴加氯水,CCl4 层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_____。
(c)加碘盐中含碘量为 20mg~50mg/kg。制取加碘盐(含 KIO3 的食盐)1000kg,若 KI 与 Cl2 反应之 KIO3,至少需要消耗 Cl2_____mol(保留 2 位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | - | - |

请回答下列问题:
(1)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按上图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128-139℃,反应一段时间。反应完成后打开K2再通氢气一段时间。
①仪器a的名称是______,装置B中盛装的试剂是______。
②反应后再通入H2的目的是______。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250mL溶液,取25.00mL所配溶液,用0.4molL-1NaOH溶液滴定,消耗NaOH溶液23.60mL,则氯化铁的转化率为______。
(2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。
①写出反应的化学方程式______。
②实验制得FeCl2后并防止氧化的操作是______。
③请指出该制备方法的缺点______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀醋酸,各加入生铁块,放置一段时间。下列有关描述错误的是

A. 生铁块中的碳是原电池的正极
B. 两试管中相同的电极反应式是:Fe-2e- = Fe2+
C. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
D. 红墨水柱两边的液面变为左低右高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com