
| ||
| ||


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
| A、1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol?L-1 |
| B、配制480 mL 1.0 mol?L-1的NaOH溶液,需NaOH固体20.0 g |
| C、将22.4LHCl气体溶于水,制成1L溶液,其浓度为1 mol?L-1 |
| D、中和100 mL 1 mol?L-1的H2SO4溶液,需NaOH 4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
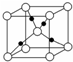 X、R、W、Y、Z是元素周期表中前四周期的五种元素,其原子序数依次增大,其中X、R、W同周期,X和Y同一主族.X原子最外层的p轨道上的电子数等于前一电子层上的电子总数,W原子最外层的p轨道中只有一个轨道填充了2个电子.Z的单质是一种紫红色金属,Z可与W形成Z2W、ZW等化合物.根据上述信息回答下列问题:
X、R、W、Y、Z是元素周期表中前四周期的五种元素,其原子序数依次增大,其中X、R、W同周期,X和Y同一主族.X原子最外层的p轨道上的电子数等于前一电子层上的电子总数,W原子最外层的p轨道中只有一个轨道填充了2个电子.Z的单质是一种紫红色金属,Z可与W形成Z2W、ZW等化合物.根据上述信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
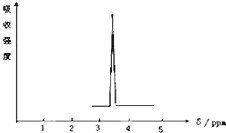 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com