
分析 ①烃1mol与2mol HCl完全加成,则该烃分子有2个双键或1个三键,1mol氯代烷能和6mol氯气发生完全取代反应,则氯代烷分子中有6个H原子,所以原烃分子中有2个H原子,据此确定.
解答 解:①烃1mol与2mol HCl完全加成,则该烃分子有2个双键或1个三键,1mol氯代烷能和6mol氯气发生完全取代反应,则氯代烷分子中有6个H原子,氯代烷分子中有2个H原子是烃与氯化氢加成引入的,所以原烃分子中有2个H原子,故该烃为HC≡C-CH3,
故答案为:HC≡C-CH3;
②CH2=CH-CHO含有醛基,能够被新制氢氧化铜氧化,方程式:CH2=CHCHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH2=CHCOONa+Cu2O↓+3H2O;
故答案为:CH2=CHCHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH2=CHCOONa+Cu2O↓+3H2O.
点评 本题考查了化学方程式的书写,侧重有机反应方程式的书写,明确有机物结构及性质是解题关键,注意醛基的性质和含有醛基物质的检验方法,题目难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 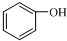 和 和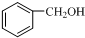 互为同系物 互为同系物 | |
| B. | 教材中做石蜡油分解实验和石油蒸馏实验都会用到碎瓷片,其作用是相同的 | |
| C. | 某烃的结构用键线式表示为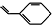 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 | |
| D. | 105℃,1.01×105Pa时,aL某气态烃在bL氧气(足量)中完全燃烧,将所得混合气体通过浓硫酸剩余气体cL,则烃燃烧生成的水蒸气的体积就是(a+b-c)L(气体体积在相同条件下测定) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
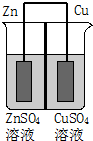 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )| A. | Zn2+通过隔膜从负极区向正极区移动 | |
| B. | 电子由Cu极通过导线流向Zn极 | |
| C. | 一段时间后ZnSO4溶液浓度增大CuSO4溶液浓度减小 | |
| D. | Cu2+与Zn2+物质的量之和保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝不易发生化学反应 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧气氧化 | |
| D. | 铝表面致密的氧化膜能阻止铝进一步被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
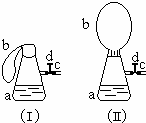 如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
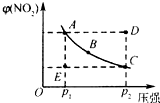 对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com