
(14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
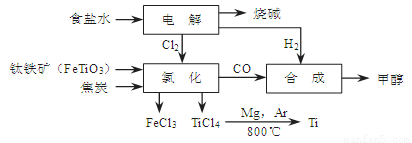
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)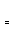 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
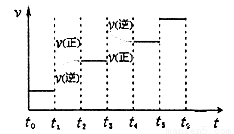
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图:
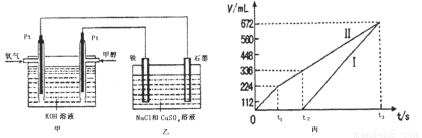
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变)
⑴ 2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO (2分)
⑵① 向逆反应方向进行(2分)
②t2~t3 (2分)升高温度 (2分)
(3)①CH3OH-6e-+8OH-=CO32-+6H2O(2分)
②4OH--4e-=O2↑+2H2O (2分) 0.1(2分)
【解析】
试题分析:⑴据流程图,钛铁矿氯化过程中反应物有FeTiO3、C、Cl2、,生成物有FeCl3、TiCl4、CO,然后根据氧化还原反应的配平方法将其配平。
⑵①此时该反应的浓度商Qc= >0.27(K),说明反应向逆反应方向进行;
>0.27(K),说明反应向逆反应方向进行;
②结合反应[CO(g)+2H2(g) CH3OH(g),正反应放热],并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。
CH3OH(g),正反应放热],并据图可确定“t1~t2”是加压,“t3~t4”是加热(升高温度),“t5~t6”是加催化剂;在t2~t3时间段内平衡混合物中的甲醇的含量最高。
⑶①装置甲为甲醇燃料电池,通入甲醇一极为负极,先根据得失电子守恒有CH3OH-6e-――CO32-,再根据电荷守恒有CH3OH-6e-+8OH―――CO32-,最后根据原子守恒得CH3OH-6e-+8OH-=CO32-+6H2O。
②装置乙为电解池,铁电极为阴极,该极发生的电极反应依次为Cu2++2e-=Cu,2H++2e-=H2↑;石墨为阳极,该极发生的电极反应式依次为2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O;据此可确定在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;根据在t1前发生的电极反应“2Cl--2e-=Cl2↑”可计算原混合溶液中NaCl的物质的量浓度: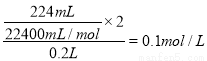 。
。
考点: 本题考查氧化还原反应方程的书写、化学平衡的移动、化学平衡图像分析、电极反应式的书写与计算。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:2013-2014河北省保定市、定兴三中高二下学期期末化学试卷(解析版) 题型:选择题
下列事实可以用同一原理解释的是( )
A.氯气和二氧化硫均可使品红褪色
B.乙烯可使溴水或酸性高锰酸钾溶液褪色
C.ClO2和漂白粉现在都常用于自来水的处理
D.苯酚和氢氧化钠溶液在空气中久置均会变质
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量,已知12克石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是( )
A. Q1<Q2
B.石墨不如金刚石稳定
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D. 质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是
A.Mg2+的结构示意图: B.CO2的电子式:
B.CO2的电子式:
C.Na2S的电子式: D.CO2的比例模型:
D.CO2的比例模型:
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
A. Na2O 和 SiO2 B.冰和金刚石熔化
C.氯化 钠和蔗糖熔化 D.碘和干冰升华
钠和蔗糖熔化 D.碘和干冰升华
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )

A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应是放热反应
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:填空题
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正) = v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列叙述中不正确的是( )
A.目前,我国城市环境污染中的大气污染物主要是SO2、NO2、CO、烟尘
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省盟校高三第二次联考理综化学试卷(解析版) 题型:选择题
完成下列实验,所选装置正确的是( )
| A | B | C | D |
实验 目的 | 检查装置气密性 | 实验室用纯碱和稀硫酸制备二氧化碳 | 用已知浓度的氢氧化钠溶液测定未知浓度盐酸 | 从碘的CCl4溶液中分离出碘 |
实验装置 |
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com