
【题目】“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是( )
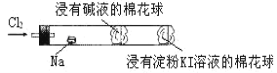
A.钠着火燃烧产生苍白色火焰,并生成大量白烟
B.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收
D.实验过程中氯元素原子并不都是被还原
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
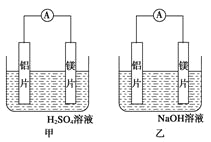
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药葛根是常用祛风解表药物,它的有效成分为葛根大豆甙元 F, 已用于治疗高血压引起的头疼、头晕、突发性耳聋等症。以下是以 A 为起始原料合成F 的一种方法:

回答下列问题:
(1) A 的化学名称为________________,B分子式为________________。
(2) C 中官能团的名称为________ , C→D的反应类型为 ______________。
(3)l molE 最多可与_____________________molH2 发生加成反应。
(4) F 与NaOH 溶液反应的化学方程式为 ________________。
(5)B 有多种同分异构体,同时满足下列条件的共有________种。
①属于芳香族化合物 ②可与NaHCO3溶液反应放出 CO2气体.其中,核磁共振氢谱有4 组峰,且峰面积之比为1:2:6:1的结构简式为 _________________(写出一种即可).
(6)已知:![]() 写出以A为原料制备化合物
写出以A为原料制备化合物![]() 合成路线____________________________ 。(无机试剂任选)
合成路线____________________________ 。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
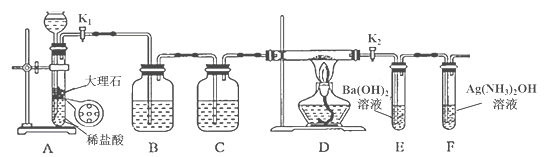
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( )
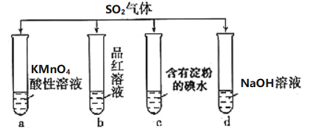
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中蓝色退去,说明还原性:SO2>I-
D.试管d中无明显现象,说明SO2不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒在研究软锰矿矿石时,把浓盐酸和软锰矿矿石混合加热,意外得到了氯气,MnO2 + 4HCl(浓)![]() MnCl2 + Cl2 ↑+ 2H2O 关于该反应的叙述不正确的是
MnCl2 + Cl2 ↑+ 2H2O 关于该反应的叙述不正确的是
A.MnO2是氧化剂B.HCl具有还原性
C.MnO2被HCl还原D.氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯A为原料制取乙酸乙酯E的过程为:
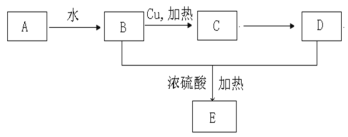
回答下列问题:
(1)由B制取C的化学反应方程式为:____________________________________________,
(2)物质D的名称为________________,B与D反应生成乙酸乙酯E的化学反应方程式为:________________________,反应类型为:____________。
(3)检验物质C可用的试剂为___________________,现象为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com