
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。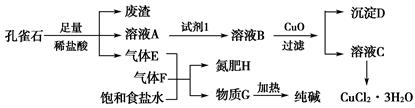
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。  教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: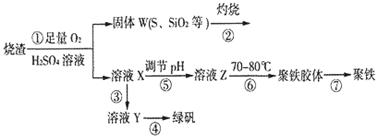
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是__________;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:___________________________________。
(3)过程③中,需加入的物质是___________________________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有_______________。
(5)过程⑤调节pH可选用下列试剂中的___________ (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是_____________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.70g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为___________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。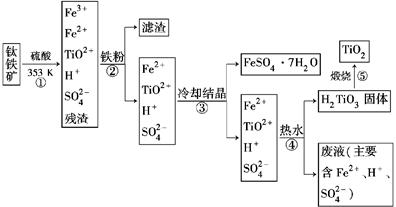
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________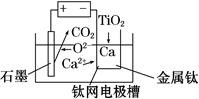
在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: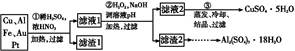
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: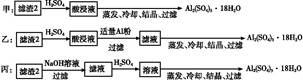
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出。现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mLA溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体。
②取25mLB溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体。
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式 ;
(2)为使上述①②反应完全,还需加入 ;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为 mol·L -1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: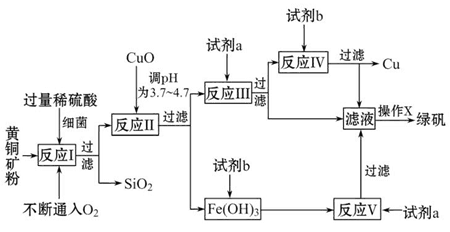
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作: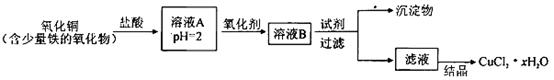
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH ④ KSCN
(2)氧化剂可选用_________。①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g)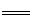 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。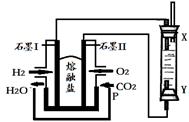
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com