
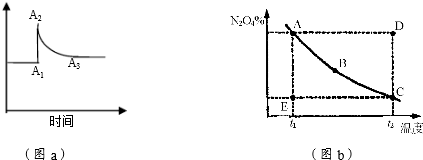
分析 (1)平衡常数只随温度变化,不随物质浓度变化,加入四氧化二氮是增大生成物浓度,平衡逆向进行;
(2)反应前后是气体体积减小的反应,二氧化氮浓度急剧增大后减小,说明是缩小容器体积,增大压强平衡正向进行;
(3)①D点要达平衡,必须降低Y的百分含量,也就是逆向建立平衡,E点要到达平衡,必须升高Y的百分含量,正向建立平衡,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等;
②温度越高反应速率越大,反应达到平衡时间越短.
解答 解:(1)平衡常数只随温度变化,不随物质浓度变化,加入四氧化二氮是增大生成物浓度,平衡逆向进行,当其他条件不变的情况下,向已平衡的反应体系中充入N2O4,K值不变,平衡逆向进行,
故答案为:不变;逆反应;
(2)分析图象和化学方程式可知,反应前后是气体体积减小的反应,二氧化氮浓度急剧增大后减小,说明是缩小容器体积,增大压强平衡正向进行,图a表示恒温条件下体系中c(NO2)的变化情况.由A1→A2,c(NO2)变化的原因是容器体积减小,浓度增大,由A2→A3,c(NO2)变化的原因是平衡向右移动,浓度减小,
故答案为:容器体积减小,浓度增大;平衡向右移动,浓度减小;
(3)①A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等,D点要达平衡,必须降低Y的百分含量,也就是逆向建立平衡,从而得出v(正)<v(逆),E点要达平衡,必须提高Y的百分含量,也就是正向建立平衡,从而得出v(正)>v(逆);
故答案为:E;
②温度越高反应速率越大,反应达到平衡时间越短,因为t1<t2,所以x>y,故答案为:>.
点评 本题考查了化学平衡的建立,平衡影响因素的分析判断,图象变化曲线的特征理解应用,掌握基础是关键,题目难度中等.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H/kJ•mol-1 | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝具有很高的熔点,故可用于制造耐高温材料 | |
| B. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| C. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故两者混合使用漂白效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中氢元素有三种同位素,它们的性质相同 | |
| B. | 三种同位素在化学反应中容易失去一个电子而呈+1价 | |
| C. | ${\;}_{1}^{1}$H原子失去一个电子后变成一个质子 | |
| D. | 氢在周期表中与碱金属同属ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应开始到10s,用Z表示的反应速率为0.079mol/(L•s) | |
| B. | 该反应的方程式为:X(g)+Y(g)?2 Z(g) | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应进行到10s时,该反应达到限度且各组分浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| B. | 加热蒸发K2CO3溶液获得K2CO3晶体 | |
| C. | 加热蒸发FeCl2溶液制取Fe(OH)2固体 | |
| D. | 加热蒸发MgCl2溶液制取MgCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com