
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
分析 二氧化硫与氨水完全反应生成盐,可能为NH4HSO3或(NH4)2SO3,向所得溶液中加入0.7mol Na2O2固体,过氧化钠能氧化NH4HSO3或(NH4)2SO3,生成硫酸根离子,充分反应后加热使气体全部逸出,气体为氨气、氧气,以此计算.
解答 解:二氧化硫与氨水完全反应生成盐,可能为NH4HSO3或(NH4)2SO3,由N原子守恒可知,物质的量分别为0.1L×5mol/L=0.5mol、0.1L×5mol/L×$\frac{1}{2}$=0.25mol,
向所得溶液中加入0.7mol Na2O2固体,
①若盐为NH4HSO3,发生Na2O2+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$2Na++SO42-+NH3↑+H2O,发生氧化还原反应消耗过氧化钠为$\frac{0.5mol×(6-4)}{2×(2-1)}$=0.5mol,同时生成氨气为0.5mol,由2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气为(0.7mol-0.5mol)×$\frac{1}{2}$=0.1mol,则气体的平均相对分子质量为$\frac{0.5×17+0.1×32}{0.5+0.1}$=19.5;
②若盐为(NH4)2SO3,发生Na2O2+2NH4++SO32-$\frac{\underline{\;\;△\;\;}}{\;}$2Na++SO42-+2NH3↑+H2O,发生氧化还原反应消耗过氧化钠为$\frac{0.25mol×(6-4)}{2×(2-1)}$=0.25mol,铵根离子完全反应,生成氨气为0.5mol,由2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气为(0.7mol-0.25mol)×$\frac{1}{2}$=0.225mol,则气体的平均相对分子质量为$\frac{0.5×17+0.225×32}{0.5+0.225}$=21.66,
③若盐为NH4HSO3、(NH4)2SO3的混合物,则生成气体的平均相对分子质量为19.5<M<21.66,
故选AB.
点评 本题考查氧化还原反应的计算,为高频考点,涉及电子守恒、平均相对分子质量的计算等,侧重分析与计算能力的考查,注意极值法在计算中的应用,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中有CaF2产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | 元素性质或结构 |
| X | 3p亚层上有1个空轨道 |
| Y | 第三周期元素形成的简单离子中半径最大 |
| Z | 短周期中原子最容易失电子 |
| A. | 氢化物的稳定性:X<Y | B. | 单质与水反应的难易程度:Y>Z | ||
| C. | 单质的熔点:X<Y<Z | D. | X、Y、Z的氧化物晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的盐酸与0.2 mol•L-1氨水等体积混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
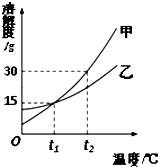 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 将甲的饱和溶液变为不饱和溶液可采用降温的方法 | |
| C. | t1℃时,甲、乙的饱和溶液中溶质的质量分数不一定相等 | |
| D. | t2℃时,将甲、乙等质量的饱和溶液降温至t1℃,甲析出的固体一定大于乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 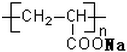 表示一种吸水性高分子树脂 表示一种吸水性高分子树脂 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 异丁烷的八氯代物共有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 表1.几种砷酸盐的Ksp | |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工厂污染物排放浓度及允许排放标准 | ||
| 污染物 | H2SO4 | As |
| 浓度 | 19.6g/L | 1.6g•L-1 |
| 排放标准 | pH6~9 | 0.5mg•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com