
【题目】硫代硫酸钠(![]() )是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生
)是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生![]() 和
和![]() 。
。
实验Ⅰ.![]() 的制备。工业上可用反应:
的制备。工业上可用反应:![]() 制得,实验室模拟该工业过程的装置如图所示。
制得,实验室模拟该工业过程的装置如图所示。

(1)仪器a的名称是__________,仪器b的名称是_____________。b中利用质量分数为70%~80%的![]() 溶液与
溶液与![]() 固体反应制备
固体反应制备![]() 反应的化学方程式为_______________________。c中试剂为________。
反应的化学方程式为_______________________。c中试剂为________。
(2)实验中要控制![]() 的生成速率,可以采取的措施有_________________________(写出一条)。
的生成速率,可以采取的措施有_________________________(写出一条)。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是_________________________。
不能过量,原因是_________________________。
实验Ⅱ.探究![]() 与金属阳离子的氧化还原反应。
与金属阳离子的氧化还原反应。
资料:![]() (紫黑色)
(紫黑色)
装置 | 试剂X | 实验现象 |
|
| 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
(4)根据上述实验现象,初步判断最终![]() 被
被![]() 还原为
还原为![]() ,通过________________________(填操作、试剂和现象),进一步证实生成了
,通过________________________(填操作、试剂和现象),进一步证实生成了![]()
【答案】分液漏斗 蒸馏烧瓶 ![]() 硫化钠和碳酸钠的混合溶液 调节酸的滴加速度 若
硫化钠和碳酸钠的混合溶液 调节酸的滴加速度 若![]() 过量,溶液显酸性,产物会发生分解 取少量反应后的溶液于试管中,加入铁氰化钾溶液,产生蓝色沉淀
过量,溶液显酸性,产物会发生分解 取少量反应后的溶液于试管中,加入铁氰化钾溶液,产生蓝色沉淀
【解析】
利用浓硫酸和亚硫酸钠固体反应制取二氧化硫,通入盛有硫化钠和碳酸钠的混合溶液的三颈烧瓶中进行反应制取硫代硫酸钠,由于硫代硫酸钠在酸性环境中容易分解,所以通入的二氧化硫不能过,装置d可以用来吸收尾气。
(1)仪器a的名称是分液漏斗,仪器b的名称是蒸馏烧瓶,b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4,c装置为Na2S2O3的生成装置,根据反应原理可知c中的试剂为:硫化钠和碳酸钠的混合溶液;
(2)可以通过控制反应的温度或硫酸的滴加速度可以控制SO2生成速率;
(3)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解;
(4)实验①的现象是混合后溶液先变成紫黑色,30s后溶液几乎变为无色,取反应后的混合液并加入铁氰化钾溶液,产生蓝色沉淀,则有Fe2+生成,可判断为Fe3+被S2O32-还原为Fe2+。


科目:高中化学 来源: 题型:
【题目】我们已经学过氢气、氧气、二氧化碳、氯气、二氧化硫、氨气等气体的制备方法和化学性质.以下是实验室制备、洗涤、干燥气体及进行尾气处理的常见仪器装置.请结合所学知识回答下列问题:
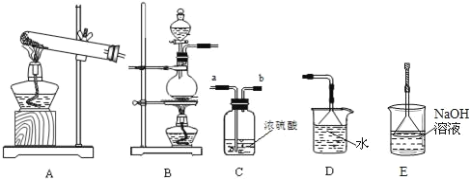
(1)下列气体中,只能用碱石灰干燥的是 ______ (填字母)
A.H2B.Cl2C.SO2D.O2
(2)实验室制取氯气反应原理的离子方程式是______,所选制备装置是______。检验氯气用______试纸;尾气处理的离子方程式为___________。
(3)实验室用氯化铵和熟石灰制取氨气,其化学反应方程式____________。工业上用氯气与石灰乳反应制备漂白粉的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g)![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1L容器中加入1mol A和1mol B发生反应,下列叙述能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1L容器中加入1mol A和1mol B发生反应,下列叙述能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化
A. ③④B. ①②C. ③⑤D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹治疗新冠肺炎具有一定疗效。磷酸氯喹由氯喹与磷酸制备,下面是由间氯苯胺合成氯喹的一种合成路线:
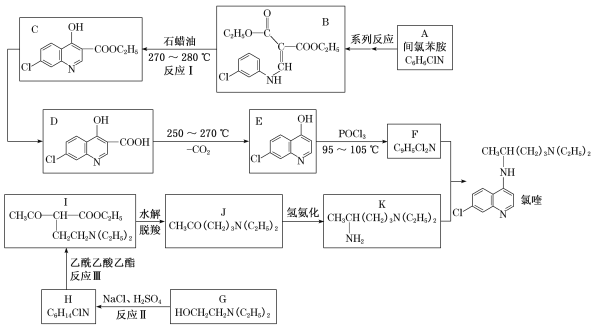
回答下列问题:
(1)已知反应I是B→C+X,推测X的名称是______,D中含氧官能团的名称是____。
(2)F的结构简式为_______________,反应II的反应类型是___________。
(3)反应III的化学方程式为____________。
(4)化合物M(C7H8ClN)是A的同系物,其某些同分异构体的核磁共振氢谱有4组峰,峰面积比为1:1:1:1,符合该要求的同分异构体有_________种。
(5)设计由氯化芐(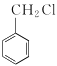 )和乙酰乙酸乙酯为原料制备
)和乙酰乙酸乙酯为原料制备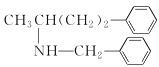 的合成路线(无机试剂任选)________。
的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。
(1)求该反应的平衡常数______。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图:
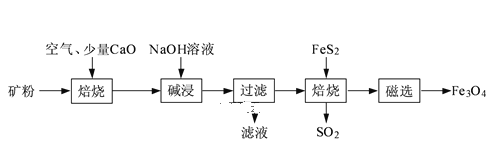
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为____。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题图所示。
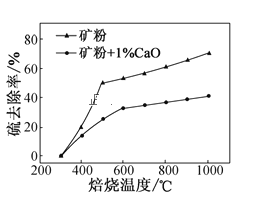
已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于____。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由___(填化学式)转化为____(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与Al混合在高温下发生的反应方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com