
下图两个装置中,液体体积均为400 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得两池均有0.02 mol电子转移,若忽略溶液体积的变化,下列叙述正确的是
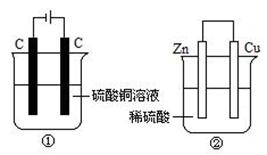
A.②装置中硫酸根离子移向铜极
B.①中阴极质量增加,②中正极质量减小
C.产生气体的物质的量: ①=②
D.溶液的pH变化:①减小,②增大
A项,②是原电池,锌作负极失电子生成Zn2+,锌极显正电性,带负电的硫酸根离子会移此极;B项,①中阴极反应式:Cu2++2e-=Cu,显然增加,②中正极反应式2H++2e-=H2↑,显然该极质量不变,故B项错误;C项,据①中电极反应式:阴极:Cu2++ 2e- =
0.2mol 0.4 mol
Cu,0.02mol小于0.4mol,即Cu2+没有放电完,
阳极:4OH- - 4e- = 2H2O + O2↑, 据②中电极反应式:正极:2H+ + 2e-= H2↑,故两
0.02 mol 0.005 mol 0.02mol 0.01mol
装置中产生气体的物质的量不相等;D项,据①中总反应式:2Cu2++2H2O![]() 2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
答案:D


科目:高中化学 来源:2012届广东省培正中学高三11月月考理科综合试题(化学部分) 题型:单选题
下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5 mol·L-1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是 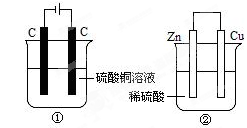
| A.产生气体体积 ①<② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑ |
| D.溶液的pH变化:①减小,②增大 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第一学期联合命题考试化学试卷 题型:选择题
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
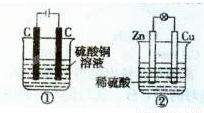
A.产生气体体积:①=②
B.溶液的pH变化:①减小,②增大
C.电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑
D.①中阴极质量增加,②中正极质量减小
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省三明市高三上学期联合命题考试化学试卷 题型:选择题
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
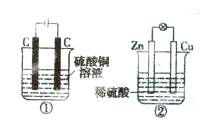
A.产生气体体积:①=②
B.溶液的pH变化:①减小,②增大
C.电极反应式:①中阳极为4 OH--4e-=2H2O+O2↑②中负极为2H++2e-=H2↑
D.①中阴极质量增加,②中正极质量减小
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省高三11月月考理科综合试题(化学部分) 题型:选择题
下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5 mol·L-1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
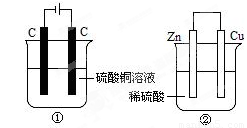
A.产生气体体积 ①<②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小,②增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com