
【题目】为了缓解温空效应,科学家提出了多种回收和利用![]() 的方案。
的方案。
![]() 方案1:利用FeO吸收
方案1:利用FeO吸收![]() 获得
获得![]()
![]()
![]()
则![]() ______。
______。
方案2:利用![]() 制备
制备![]()
![]() 时,向2L恒容密闭容器中充入
时,向2L恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,混合气体中
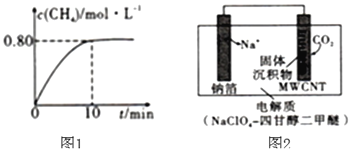
,混合气体中![]() 的浓度与反应时间的关系如图1所示。
的浓度与反应时间的关系如图1所示。
![]() ①从反应开始到恰好达到平衡时,
①从反应开始到恰好达到平衡时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。
②![]() 时,反应的平衡常数
时,反应的平衡常数![]() ______。
______。
③保持温度不变,向平衡后的容器中再充入![]() 和
和![]() ,重新达到平衡时
,重新达到平衡时![]() 的浓度______
的浓度______![]() 填序号
填序号![]() 。
。
A.等于![]()
![]() 等于
等于![]()
![]()
![]() 大于
大于![]()
![]() 时,如果该容器中有
时,如果该容器中有![]() 、
、![]() 、
、![]() 、
、![]() 。则
。则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() “
“![]() 。
。
![]() 已知:
已知:![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() 则
则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
方案3:利用“![]() ”电池将
”电池将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池以钠箔和多壁碳纳米管
”电池以钠箔和多壁碳纳米管![]() 为电极材料,总反应为
为电极材料,总反应为![]()
![]()
![]() 放电时该电池“吸入”
放电时该电池“吸入”![]() ,其工作原理如图2所示:
,其工作原理如图2所示:![]() 假设开始时两极的质量相等
假设开始时两极的质量相等![]()
![]() ①放电时,正极的电极反应式为______。
①放电时,正极的电极反应式为______。
②若生成的![]() 和C全部沉积在电极表面,当转移
和C全部沉积在电极表面,当转移![]() 时,两极的质量差为______g。
时,两极的质量差为______g。
![]() 室温下,物质的量浓度均为
室温下,物质的量浓度均为![]() 的几种含碳盐溶液的pH如下表:
的几种含碳盐溶液的pH如下表:
序号 | ① | ② | ③ |
溶液 |
| NaX |
|
pH |
|
|
|
写出溶液②中通入少量![]() 的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
【答案】![]()
![]() 25 D
25 D ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)![]()
![]()
将方程式(①+②)÷2得![]() 进行相应的改变;
进行相应的改变;
(2)①从反应开始到恰好达到平衡时,CH4的平均反应速率v(CH4)=0.80mol/L÷10min=0.08mol/(L.min),
相同时间内各物质的平均反应速率之比等于其计量数,据此计算氢气反应速率;
②可逆反应 CO2(g)+4H2(g)CH4(g)+2H2O(g)
开始(mol/L) 1 4 0 0
反应(mol/L) 0.8 0 3.20 0.80 1.60
平衡(mol/L) 0.20 0.80 0.80 1.60
300C时,反应的平衡常数K=c(CH4)×c2(H2O)÷(c(CO2)×c4(H2));
③保持温度不变,向平衡后的容器中再充入2mol CO2和8mol H2,相当于增大压强,平衡正向移动,导致甲烷浓度大于原来2倍;
(3)300C时,如果该容器中有1.6mol CO2、2.0mol H2、5.6mol CH4、4.0mol H2O (g),此时c(CO2)=0.8mol/L、c(H2)=1.0mol/L、c(CH4)=2.8mol/L、c(H2O)=2.0mol/L,浓度商= c(CH4)×c2(H2O)÷(c(CO2)×c4(H2))=2.8×2.02÷(0.8×1.04)=14<25,根据浓度商与化学平衡常数相对大小判断平衡移动方向,从而确定正逆反应速率相对大小;
(4)200C时,该反应的平衡常数K=![]() ,300C时该反应化学平衡常数K为25L2mol2,升高温度平衡向吸热方向移动,升高温度该反应平衡常数减小,说明平衡逆向移动;
,300C时该反应化学平衡常数K为25L2mol2,升高温度平衡向吸热方向移动,升高温度该反应平衡常数减小,说明平衡逆向移动;
(5)①根据电池反应式知,放电时,Na作负极、碳纳米管为正极,正极上二氧化碳得电子和钠离子反应生成碳酸钠和C;
②若生成的Na2CO3和C全部沉积在电极表面,负极上钠失电子生成钠离子进入电解质,负极反应式为Nae=Na+,当转移0.2mole时,负极质量减少量=0.2mol1×23g/mol=4.6g,正极增加的质量为碳酸钠和C的质量,正极增加质量=0.2mol÷4×2×106g/mol+0.2mol÷4×1×12g/mol=10.6g+0.6g=11.2g;
(6)①相同浓度弱酸的钠盐溶液,弱酸根离子水解程度越大该溶液的pH越大,相对应的酸的酸性越弱,强酸能和弱酸盐反应生成弱酸,根据溶液pH知,水解程度CO32>X>HCO3-,则酸性HCO3-<HX<H2CO3,溶液②中通入少量CO2,碳酸和X反应生成HX和HCO3-;
水解程度CO32>X>HCO3-,二者水解都生成OH导致溶液呈碱性,但是其水解程度都较小。
(1)![]()
![]()
将方程式(①+②)÷2得![]() 12×(76.0+113.4)kJ/mol=+18.7kJ/mol,
12×(76.0+113.4)kJ/mol=+18.7kJ/mol,
故答案为:+18.7kJ/mol;
(2)①从反应开始到恰好达到平衡时,CH4的平均反应速率v(CH4)=0.80mol/L10min=0.08mol/(L.min),
相同时间内各物质的平均反应速率之比等于其计量数,则氢气反应速率=4v(CH4)=4×0.08mol/(L.min)=![]() ,
,
故答案为:![]() ;
;
②可逆反应 CO2(g)+4H2(g)CH4(g)+2H2O(g)
开始(mol/L) 1 4 0 0
反应(mol/L) 0.80 3.20 0.80 1.60
平衡(mol/L) 0.20 0.80 0.80 1.60
300C时,反应的平衡常数K=c(CH4)×c2(H2O)÷(c(CO2)×c4(H2))=0.80×1.602÷(0.20×0.804)=25,
故答案为:25;
③保持温度不变,向平衡后的容器中再充入2mol CO2和8mol H2,相当于增大压强,平衡正向移动,导致甲烷浓度大于原来2倍,即甲烷浓度大于1.6mol/L,
故选D;
(3)300C时,如果该容器中有1.6mol CO2、2.0mol H2、5.6mol CH4、4.0mol H2O (g),此时c(CO2)=0.8mol/L、c(H2)=1.0mol/L、c(CH4)=2.8mol/L、c(H2O)=2.0mol/L,浓度商= c(CH4)×c2(H2O)÷(c(CO2)×c4(H2))=2.8×2.02÷(0.8×1.04)=14<25,平衡正向移动,则正反应速率大于逆反应速率,
故答案为:>;
(4)200C时,该反应的平衡常数K=![]() ,300C时该反应化学平衡常数K为25 L2mol2,升高温度平衡向吸热方向移动,升高温度该反应平衡常数减小,说明平衡逆向移动,则正反应是放热反应,反应热小于0,
,300C时该反应化学平衡常数K为25 L2mol2,升高温度平衡向吸热方向移动,升高温度该反应平衡常数减小,说明平衡逆向移动,则正反应是放热反应,反应热小于0,
故答案为:<;
(5)①根据电池反应式知,放电时,Na作负极、碳纳米管为正极,正极上二氧化碳得电子和钠离子反应生成碳酸钠和C,电极反应式为![]() ,
,
故答案为:![]() ;
;
②若生成的Na2CO3和C全部沉积在电极表面,负极上钠失电子生成钠离子进入电解质,负极反应式为Nae=Na+,当转移0.2mole时,负极质量减少量=0.2mol×23g/mol=4.6g,正极增加的质量为碳酸钠和C的质量,正极增加质量=0.2mol÷4×2×106g/mol+0.2mol÷4×1×12g/mol=10.6g+0.6g=11.2g,则正负极质量差=11.2g+4.6g=15.8g,
故答案为:15.8;
(6)相同浓度弱酸的钠盐溶液,弱酸根离子水解程度越大该溶液的pH越大,相对应的酸的酸性越弱,强酸能和弱酸盐反应生成弱酸,根据溶液pH知,水解程度CO32>X>HCO3-,则酸性HCO3-<HX<H2CO3,溶液②中通入少量CO2,碳酸和X反应生成HX和HCO3-,离子方程式为![]() ;
;
等体积的①和③形成的混合溶液中离子浓度由大到小排列为![]()
故答案为:![]() ;
;
![]() 。
。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
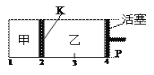
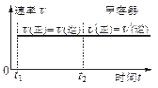
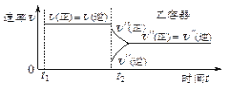
图1 图2 图3
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-6molL-1
B.浓度均为0.1 molL-1的CuSO4和(NH4)2SO4的混合溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)
C.0.1 molL-1NaF溶液中加入NH4Cl至中性:c(HF)=c(NH3H2O)
D.0.100 molL-1的Na2S溶液中通入HCl气体,至c(Cl-)=0.100 molL-1(忽略溶液体积的变化及H2S的挥发):c(OH-)-c(H+)=c(HS-)-c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为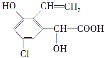 ,下列关于该有机物的说法中不正确的是
,下列关于该有机物的说法中不正确的是
A. 遇FeCl3溶液显紫色
B. 与足量的氢氧化钠溶液在一定条件下反应,最多消耗NaOH 3 mol
C. 能发生缩聚反应和加聚反应
D. 1 mol该有机物与浓溴水反应,最多消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是

选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
D | ④通电 | B极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com