
【题目】下列说法不正确的是( )
A.实验室可用![]() 与浓盐酸在加热条件下制得
与浓盐酸在加热条件下制得![]()
B.![]() 溶液经过蒸发结晶转化为
溶液经过蒸发结晶转化为![]() ,再直接加热脱水即可得
,再直接加热脱水即可得![]()
C.铝热反应可用于焊接铁轨、冶炼难熔金属
D.硝酸分别与甲苯、甘油在合适的条件下反应,均可制得炸药
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学小组探究在其他条件不变时,改变某一条件对某类反应aA(g)+bB(g)![]() cC(g)的 化学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n 表示物质的量,α表示转 化率)。下列说法正确的是( )
cC(g)的 化学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n 表示物质的量,α表示转 化率)。下列说法正确的是( )
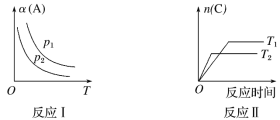
A.反应Ⅰ的正反应ΔH>0B.若p1>p2,则a+b<c
C.反应Ⅱ的逆反应ΔH>0D.反应Ⅱ中T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
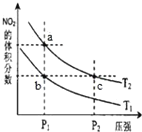
A.a、c两点气体的平均相对分子质量:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点的反应速率:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molH2(g)与1molI2(g)反应生成HI(g)释放出8.7kJ热量,有关数据如图所示:
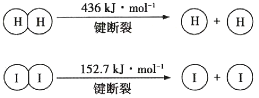
下列说法不正确的是( )
A.H2和I2的总能量低于HI的能量
B.破坏1molH—I键需要的能量是298.7kJ
C.1molHI(g)完全分解生成H2(g)和I2(g)时吸收4.35kJ热量
D.H2(g)中的H—H键比HI(g)中的H—I键牢固
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
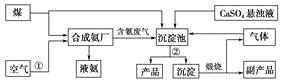
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
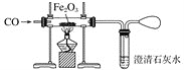
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘可利用的资源有限,因此碘的工业回收有重要意义。如图是某研究小组设计的从实验室含碘废液(主要含有![]() 、
、![]() 和淀粉等)中回收获得高纯碘晶体的流程。
和淀粉等)中回收获得高纯碘晶体的流程。

已知:![]() ,
,![]() ,实验条件下
,实验条件下![]() 不与
不与![]() 发生氧化还原反应。回答下列问题:
发生氧化还原反应。回答下列问题:
(1)步骤I中,在装有含碘废液的烧杯中,先加入![]() 固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
(2)下列有关步骤I的说法正确的是_________________。
A.实验中应调节![]() 为强酸性环境
为强酸性环境
B.![]() 溶液不能先于
溶液不能先于![]() 晶体加入,是为了防止生成的碘挥发而损失
晶体加入,是为了防止生成的碘挥发而损失
C.加入硫代硫酸钠的量应控制至含碘废液的蓝色刚好褪去
D.溶液![]() 中含硫元素的离子可能有
中含硫元素的离子可能有![]() 、
、![]() 、
、![]() 等
等
(3)步骤Ⅱ为反应生成碘并蒸馏出碘的过程,示意图如图所示:
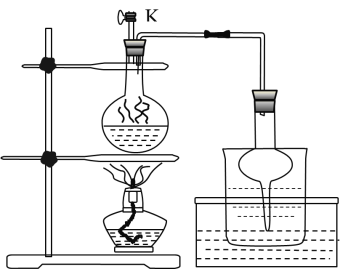
①写出步骤Ⅱ的离子方程式________。
②步骤Ⅱ,检查装置气密性(此时![]() 关闭),在圆底烧瓶中加入
关闭),在圆底烧瓶中加入![]() 和
和![]() 固体及适量
固体及适量![]() ,其后续的操作顺序是________。(选择合理操作,并排序)
,其后续的操作顺序是________。(选择合理操作,并排序)
a.打开![]() b.关闭
b.关闭![]() c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
③实验后期,发现玻璃管中少量碘晶体凝结,其处理的简易操作方法________;
(4)步骤Ⅲ中,主要涉及的操作依次是抽滤、洗涤、干燥和________。其中,抽滤、洗涤沉淀后的滤纸不能丢弃,应保留到后续操作中,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、![]() 盐酸、
盐酸、![]() 溶液,尚缺少的实验玻璃用品是____、___.
溶液,尚缺少的实验玻璃用品是____、___.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____(填“能”或“否”),其原因是____.
(3)实验中![]() 的浓度比
的浓度比![]() 的大,其原因是________
的大,其原因是________
(4)若用![]() 代替
代替![]() ,对测定结果________(填“有”或“无”)影响;若用醋酸代替
,对测定结果________(填“有”或“无”)影响;若用醋酸代替![]() 做实验,则测定结果________(填“偏高”“偏低”或“无影响”).
做实验,则测定结果________(填“偏高”“偏低”或“无影响”).
(5)他们记录的实验数据如下:已知:![]() ,反应后溶液的比热容
,反应后溶液的比热容![]() 为
为![]() ,各物质的密度均为
,各物质的密度均为![]() .计算完成下表_______
.计算完成下表_______
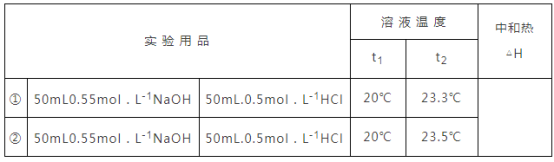
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸![]() 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
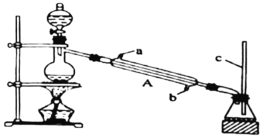
Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸![]() 与甲醇
与甲醇![]() 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度 | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是__________,长玻璃管c的作用是__________、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,![]() 能与
能与![]() 固体发生反应:
固体发生反应:![]() 。
。
(1)如图所示是以甲酸钠![]() 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:
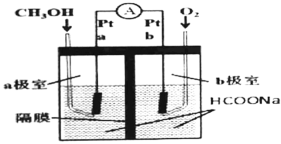
则a极电极反应式为_______________。
(2)测定产物中甲酸钠![]() 的纯度:
的纯度:![]() 与足量
与足量![]() 充分反应后,消耗标况下
充分反应后,消耗标况下![]() ,所得固体物质为
,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com