
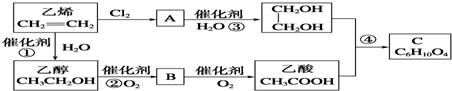
分析 乙烯与氯气发生加成反应生成A,A为ClCH2CH2Cl,在氢氧化钠水溶液、加入条件下发生水解反应生成乙二醇.乙烯与水发生加成反应生成乙醇,乙醇氧化生成B,B氧化生成乙酸,故B为CH3CHO.乙酸与乙二醇发生酯化反应生成C,由C的分子式C6H10O4可知,C为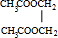 ,据此解答.
,据此解答.
解答 解:乙烯与氯气发生加成反应生成A,A为ClCH2CH2Cl,在氢氧化钠水溶液、加入条件下发生水解反应生成乙二醇.乙烯与水发生加成反应生成乙醇,乙醇氧化生成B,B氧化生成乙酸,故B为CH3CHO.乙酸与乙二醇发生酯化反应生成C,由C的分子式C6H10O4可知,C为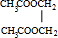 ,
,
(1)A为ClCH2CH2Cl,含有的官能团为氯原子,B为CH3CHO,含有醛基,
故答案为:氯原子;醛基;
(2)由上述分析可知,A的结构简式为:ClCH2CH2Cl,
故答案为:ClCH2CH2Cl;
(3)反应①是乙烯与水发生加成反应生成乙醇,
反应③ClCH2CH2Cl发生水解反应生成乙二醇,水解反应属于取代反应,
故答案为:加成;水解(取代);
(4)乙醇的同分异构体的结构简式为CH3OCH3,故答案为:CH3OCH3;
(5)反应②为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应④为2CH3COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O;
(6)B为CH3CHO,CH3CHO与新制Cu(OH)2悬浊液反应的化学方程式为CH3CHO+2Cu(OH)2+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$CH3COONa+Cu2O↓+3H2O,
故答案为:CH3CHO+2Cu(OH)2+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$CH3COONa+Cu2O↓+3H2O.
点评 本题考查有机物之间的转化关系,涉及烯烃、醇、醛、羧酸、卤代烃性质,考查官能团、有机反应类型、同分异构体、方程式书写等,掌握官能团的性质是解题的关键,难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中Na+、Mg2+、AlO${\;}_{2}^{-}$、NO${\;}_{3}^{-}$可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 通入H2S气体无明显现象,原因是二者不反应 | |
| D. | 与少量Ba(OH)2溶液反应的离子方程式:Al3++2SO${\;}_{4}^{2-}$+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
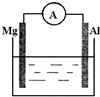 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和M原子的最外层电子数之差不一定为5 | |
| B. | A和M原子的最外层电子数之和一定为7 | |
| C. | A和M原子的电子数之差一定为11 | |
| D. | A和M的原子序数之差不一定为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应不一定是吸收热量的反应 | |
| B. | 科学家经常在金属与非金属的交界线处寻找良好的半导体材料 | |
| C. | 催化剂是影响化学反应速率和化学平衡的一个重要因素 | |
| D. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该微粒的质量数为2 | |
| B. | 该微粒不显电性 | |
| C. | 它与普通中子互称为同位素 | |
| D. | 在元素周期表中与氢元素占同一位置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com