
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.分析 (1)①化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
②反应方程式中,系数之比等于物质的量之比;
(2)根据盖斯定律结合热化学方程式的书写来回答;
(3)①化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,固态和纯液体不列入;
a.该反应中只有生成物是气体,生成的氨气和二氧化碳质量和物质的量比值不变;
b.化学平衡常数只受温度影响;
c.降温平衡向逆向移动;
②图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率.
解答 解:(1)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:A、NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,所以该反应的△H=-196.6kJ•mol-1-2(-41.8kJ•mol-1)=-113.0 kJ•mol-1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1;
(3)①尿素和水不是气体,不列入,K=c2(NH3)•c(CO2),
a.该反应中只有生成物是气体,生成的氨气和二氧化碳质量和物质的量比值不变,故a正确;
b.化学平衡常数只受温度影响,温度不变其不变,故b错误;
c.该反应是吸热反应,降温平衡逆向移动,反应物转化率降低,故c错误;
故答案为:c2(NH3)•c(CO2);a;
②氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:>;75%.
点评 本题为综合题,为高考常见题型,考查了盖斯定律求热化学方程式,化学平衡的移动及平衡的计算,平衡常数的计算,题目难度大,熟悉平衡原理是解题关键.


科目:高中化学 来源: 题型:解答题

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
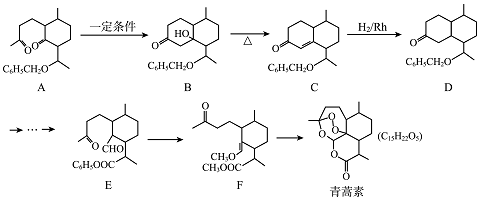
 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.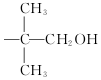 基团;
基团;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
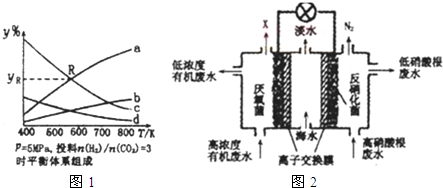
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
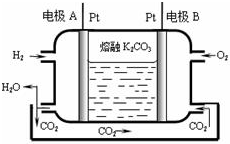 碳及其化合物应用广泛.
碳及其化合物应用广泛. (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2→CO2+2H2O | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤干馏制得煤焦油和焦炭 | |
| B. | 从海水中可以得到氯化镁,再加热分解可制金属镁 | |
| C. | 将石油裂解制得乙烯等化工原料 | |
| D. | 煤的气化主要反应是C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com