
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)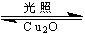 2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ。
(2)现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
物质的量 | CO | H2 O | CO2 | H2 |
甲 | a mol | a mol | 0 mol | 0 mol |
乙 | 0mol | 0 mol | 2a mol | a mol |
丙 | 0 mol | 0 mol | a mol | a mol |
丁 | a mol | a mol | a mol | a mol |
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为 。
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 。
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成份 | WO3 W2O5 WO2 W |
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 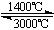 WI4 (g)。下列说法正确的有 (填字母)。
WI4 (g)。下列说法正确的有 (填字母)。
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2016届河南省英文学校高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 。
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾(NO2)的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
写出A与X的溶液反应的离子方程式
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(6分)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净[Cl2Na(NCO)3,氯元素为+1价]先与水反应,生成次氯酸(HClO)起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸)除去。
(1)优氯净中氮元素的化合价为 。
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+=H2O+Ca CO3↓
B.氯化铵与氢氧化钠溶液混合:NH4++OH-=H2O+NH3↑
C.向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O= CaSO4↓+Cl-+2HClO
D.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
查看答案和解析>>
科目:高中化学 来源:2016届安徽省皖南八校高三上学期第一次联考化学试卷(解析版) 题型:填空题
2015年9月20日“长征六号”运载火箭成功将20颗微小卫星送入太空,创造了中国航天一箭多星的新纪录。“长征六号”运载火箭采用无毒环保的过氧化氢一煤油为推进剂。
(1)石油经过 可获得汽油、煤油、柴油、重油等,通过将重油_______可获得更多的汽油、煤油等轻质油。
(2)煤油中的主要组成元素是 (填元素符号)。
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是 (填化学式),每产生1mol气体时转移电子的物质的量为__________。
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):

①在60℃、pH=3.1条件下,H2O2的分解速率为__________mol/(L·min)(已知30%的H2O2溶液的密度为1.11 g/cm3,反应过程中溶液体积变化忽略不计,计算结果保留两位有效数字)。
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为_____________(填标号)。
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
查看答案和解析>>
科目:高中化学 来源:2016届安徽省三校高三上学期二次模拟化学试卷(解析版) 题型:实验题
(15分)铁、铝及其化合物在生活、生产中有着广泛的应用。
Ⅰ.某研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解进行研究。该小组同学称取a g硫酸亚铁晶体样品按下图图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。
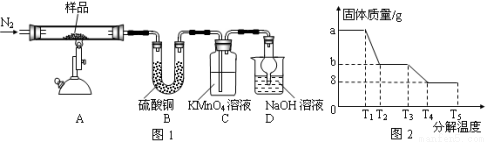
(1)装置B中硫酸铜粉末变蓝,质量增加12.6 g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一种物质SO3,写出FeSO4分解的化学方程式 。
(5)某研究所利用SDTQ 600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系图如上图图2。根据两种热分解实验的有关数据,可计算出FeSO4•xH2O中的x= 。
Ⅱ.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的操作方法为: 。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填选项编号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:
边滴加浓盐酸边蒸发浓缩、 (填操作名称)、过滤、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上期中测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.氯气与氢氧化钠溶液反应:Cl2 + 2OH-=Cl-+ ClO-+ H2O
B.碳酸钙与稀醋酸反应:CO32-+ 2CH3COOH =2CH3COO-+ H2O + CO2↑
C.铁粉与稀盐酸反应:2Fe + 6H+=2Fe3+ + 3H2↑
D.铜片与氯化铁溶液反应 Cu + Fe3+ =Cu2+ + Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届福建省大田市高三上学期第一次月考化学试卷(解析版) 题型:填空题
现用质量分数为36.5%的浓盐酸(密度为1.19 g/cm3)配制1 mol/L的稀盐酸90 mL。
(1)实验中应选用的仪器是(填序号)____ ____;
①100 mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶
⑤10 mL量筒 ⑥50 mL烧杯 ⑦100 mL容量瓶 ⑧胶头滴管
(2)经计算,需量取浓盐酸的体积为____________mL;
(3)此实验中玻璃棒的作用是_________________________;
(4)某学生实际配制稀盐酸的浓度,经滴定测量为0.98 mol/L,原因可能是下列操作中____ ____。
①取用完浓盐酸的量筒未洗涤
②转移溶液后,小烧杯未洗涤
③定容时俯视容量瓶刻度线
④移液前容量瓶内有少量蒸馏水
⑤定容摇匀后液面下降再加水
⑥定容时仰视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期10月月考化学试卷(解析版) 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com