
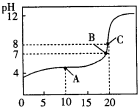
| Kw |
| Kh |
 ,故答案为:
,故答案为: ;
;| 10-6×10-6 |
| 0.05 |
| Kw |
| Kh |
| 10-14 |
| 2×10-11 |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:

| (b+d) |
| 2 |
| (c+e) |
| 2 |

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 相关信息 |
| X | X的一种核素质量数为14,中子数为7 |
| Y | Y的过氧化物是一种淡黄色固体,可用作供氧剂 |
| Z | Z的基态原子M层电子数比L层少2个 |
| W | W的基态原子的价电子排布式为3d104sl |
查看答案和解析>>
科目:高中化学 来源:2009年山东省高考理综化学模拟题3 题型:022
A物质的化学式为XY2,X、Y为元素周期表前三周期的元素,其阳离子和阴离子电子层结构相同,且1 mol XY2含有30 mol电子.请回答下列问题:
(1)X基态原子的核外电子排布式为________,A物质的化学式________.
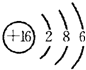
(2)元素D、E同周期,D原子的最外层电子数是其电子层数的3倍,D与Y相邻,则D的离子结构示意图是________;E原子的最外层电子数是其电子层数的2倍,D与E形成非极性分子,该分子的结构式为________.
(3)W为短周期元素,且与E同主族,其单质是________晶体;DW形成的晶体的化学式是______________.
(4)Y的氢化物能用于刻蚀玻璃,Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com