
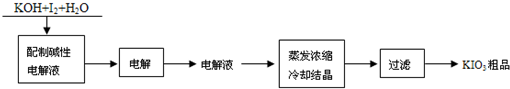


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
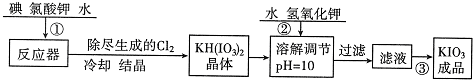
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
| 1270 |
| 3w |
| 423.33 |
| w |
| 1270 |
| 3w |
| 423.33 |
| w |
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
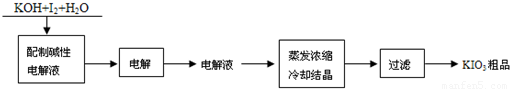
科目:高中化学 来源:2010年广东省广州市高考化学模拟试卷(三)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com