
分析 (1)在Cl2、Cl-、H+中氢元素处于最高价具有氧化性,Cl2、H+中氧化性最强的是Cl2;
(2)①NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应;
②2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
③反应MnO2+4HCl(浓$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Cl元素的化合价升高,盐酸表现还原性,且生成氯化锰,盐酸表现酸性;
(3)Mn元素的化合价从+4价降为+2价,Cl元素从-1价升高为0价,可通过双线桥分析此氧化还原反应;
(4)已知H2S为反应物,则反应为H2S→S,则另一反应物应具有氧化性,应为FeCl3,则发生反应为2FeCl3+H2S═2FeCl2+S↓+2HCl.
解答 解:(1)在Cl2、Cl-、H+中氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2,
故答案为:Cl2、H+;Cl2;
(2)①NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;故答案为:酸性;
②2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl既表现氧化性又表现还原性,故答案为:既表现氧化性又表现还原性;
③反应MnO2+4HCl(浓$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Cl元素的化合价升高,盐酸表现还原性,且生成氯化锰,盐酸表现酸性,故答案为:酸性和还原性;
(3)Mn元素的化合价从+4价降为+2价,Cl元素从-1价升高为0价,可通过双线桥分析此氧化还原反应, ,故答案为:
,故答案为: ;
;
(4)已知H2S为反应物,则反应为H2S→S,则另一反应物应具有氧化性,应为FeCl3,则发生反应为2FeCl3+H2S═2FeCl2+S↓+2HCl,
故答案为:2FeCl3+H2S═2FeCl2+S↓+2HCl.
点评 本题考查氧化还原反应的综合应用,为高频考点,题目难度中等,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.


科目:高中化学 来源: 题型:解答题
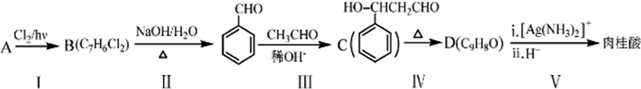

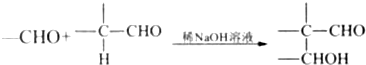
 .
. .肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是
.肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属甲比金属乙容易失去电子,则甲比乙金属性强 | |
| B. | NaHCO3与NaOH反应有CO2生成 | |
| C. | 稀硝酸能将亚铁离子氧化为铁离子 | |
| D. | Na2CO3不能用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(W)<r(Z)<r(Y) | |
| C. | X的简单气态氢化物的热稳定性比W的强 | |
| D. | Z的最高价氧化物对应的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应前后是否有元素化合价变化,可将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 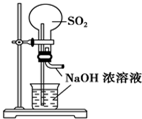 用SO2做喷泉实验 | B. | 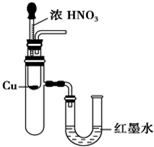 验证CU与浓HNO3反应的热量变化 | ||
| C. | 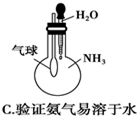 验证氨气易溶于水 | D. | 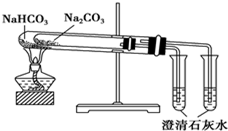 比较Na2CO3与NaHCO3的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液中:AlO2-、Na+、SO42-、SO32- | |
| B. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| C. | 加入甲基橙呈黄色的溶液:NH4+、Fe2+、Cl-、NO3- | |
| D. | c(H+)=0.10 mol•L-1的溶液中:CH3COO-、NH4+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石、白磷都属于单质 | B. | 漂白液、石英都属于纯净物 | ||
| C. | 纯碱、烧碱都是碱 | D. | 蔗糖、蛋白质都属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com