
| A. | 氢氧化铝可作胃酸的中和剂 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 制备单晶硅的过程中不发生氧化还原反应 |
分析 A.氢氧化铝具有弱碱性.能够与盐酸反应;
B.烟花是不同金属产生焰色反应;
C.二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅与氢氟酸反应生成四氟化硅和水,氢氧化钠与氢氟酸反应生成氟化钠和水;
D.有化合价变化的反应为氧化还原反应.
解答 解:A.氢氧化铝具有弱碱性.能够与盐酸反应,可以用来治疗胃酸过多,故A正确;
B.烟花中添加了含钾、钠、钙、铜等金属元素,燃烧时焰色反应发出各种颜色的光,故B正确;
C.二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅与氢氟酸反应生成四氟化硅和水,氢氧化钠与氢氟酸反应生成氟化钠和水,所以三者两两都能发生反应,故C正确;
D.石英的成分是二氧化硅,二氧化硅和碳反应制取粗硅,该反应中硅元素的化合价发生变化,所以是氧化还原反应,故D错误;
故选:D.
点评 本题考查学生关注化学与工农业生产、日常生活、社会热点问题,涉及元素化合物性质及用途,焰色反应的应用,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
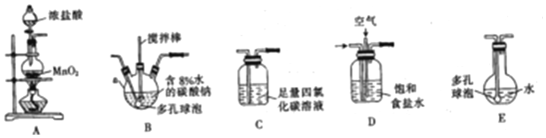
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
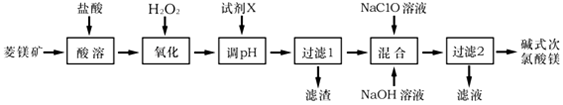
 ,它的作用是将Fe2+氧化为Fe3+.
,它的作用是将Fe2+氧化为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | Na2O2中既含有离子键又含有非极性共价键 | |
| C. | KOH中只含有共价键 | |
| D. | KI和HI中化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
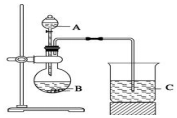 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
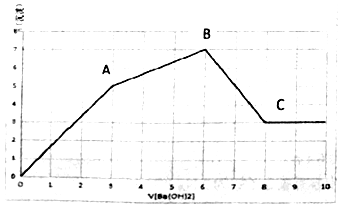 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )| A. | OA段反应的离子方程式为Al3++3OH-+Ba2++SO42-=Al(OH)3↓+BaSO4↓ | |
| B. | B点对应的溶液中,Na+、CO32-、NO3-可以大量共存 | |
| C. | C点对应的溶液中,通入过量的CO2气体有白色沉淀生成 | |
| D. | 原溶液中Al2(SO4)3和AlCl3的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com