
【题目】现有几组物质的熔点(℃)的数据:
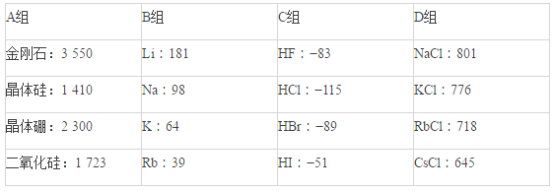
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
【答案】原子 共价键 ①②③④ HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可) ②④ D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高
【解析】
(1)A组熔点最高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键;
故答案为:原子;共价键;
(2)B组物质为金属,具有金属光泽、导电性、导热性、延展性,故答案为:①②③④;
(3)由于HF分子间存在氢键,导致HF的沸点比其它氢化物的沸点高,故答案为:HF分子间能形成氢键,其熔化时需要消耗的能量更多;
(4)D组物质为离子晶体,离子晶体具有硬而脆、水溶液能导电、固体不能导电而熔融状态能导电的性质,故答案为:②④;
(5)离子晶体中,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高;
故答案为:D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.苯酚与碳酸钠溶液反应:2![]() +CO32-→
+CO32-→![]() +CO2↑+H2O
+CO2↑+H2O
B.硫酸铜与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O =Cu(OH)2↓+2NH4+
C.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使Al3+刚好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D.少量SO2通入足量Ca(ClO)2溶液中:SO2+Ca2++ClOˉ+H2O=CaSO4+2H++Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是

A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中先滴加稀硝酸,再滴加 | 该溶液中一定含有 |
B | 向 |
|
C | 向 |
|
D | 用 | 酸性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。


请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是__________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图,下列相关判断正确的是
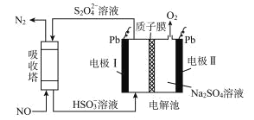
A.电极 I为阴极,电极反应式为 2H2O+2e-=2OH-+H2↑
B.电解池中质子从电极 I 向电极Ⅱ作定向移动
C.每处理 1 mol NO 电解池右侧质量减少 16 g
D.吸收塔中的反应为 2NO+2S2O42-+H2O=N2+4HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
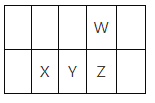
A.原子半径:W<XB.常温常压下,Y单质为固态
C.最高价氧化物对应水化物的酸性:Y<ZD.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) ΔH3=___。
(2)CO2甲烷化反应是由法国化学家Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图:
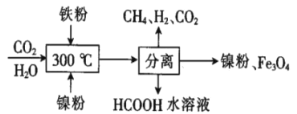
上述过程中,产生H2反应的化学方程式为__。
②HCOOH是CO2转化为CH4的中间体:CO2![]() HCOOH
HCOOH![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
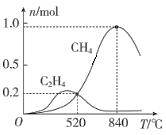
在1L恒容密闭容器中充入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。520℃时,CO2的转化率为__,520℃时,反应I的平衡常数K=__。
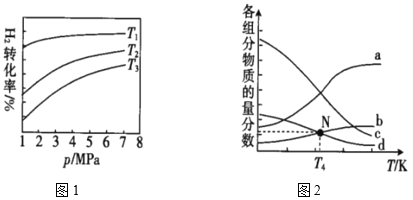
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=![]() 。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20Mpa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向显蓝色的淀粉溶液中通入足量![]() 后变成无色溶液:
后变成无色溶液:![]()
B.电离平衡常数:![]() ,向
,向![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
C.![]() 溶液与过量
溶液与过量![]() 溶液反应:
溶液反应:![]()
D.![]() 溶液中通入过量
溶液中通入过量![]() :
:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com