
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
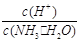 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.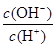
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
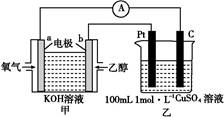
据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
| A.升温 | B.加压 |
| C.加催化剂 | D.增加CO2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2; 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中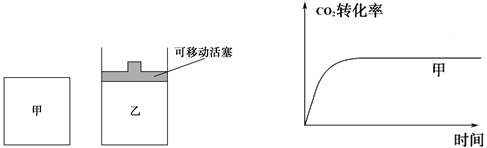
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
| | 活性炭/mol | NO/mol | A/mol | B/mol |
| 起始状态 | 2.030 | 0.100 | 0 | 0 |
| 2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 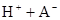 | 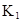 | 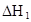 |  |
在苯中,2HA 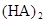 | 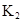 | 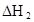 | 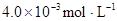 |
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则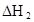 ___________0。
___________0。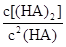 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
| A.甲中气体的总压强不变 | B.各气体的物质的量浓度不变 |
| C.混合气体的平均摩尔质量不变 | D.混合气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定条件下,反应室(容积恒定为2L)中有反应:A(g) +2B(g) C(g)
C(g)
(1)能说明上述反应达到平衡状态的是 (选填字母)。
A.反应中A与B的物质的量浓度之比为1︰2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2υ正(A)= υ逆(B)
(2)该反应平衡常数K的表达式:K= 。
(3)1molA(g)与2molB(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如下图所示,则:
①P1 P2 , 正反应的△H 0(填“<”、“>”或“=”)。
②下列措施中一定能使c(C)/c(A)增大的是 (选填编号)。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(4)100℃时将1mol A和2molB通入反应室,保持温度不变,10min末C(g) 的浓度为0.05mol/L ,则10min末B转化率= ,此时υ正 υ逆
(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com