
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol,则Q1>Q2 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
分析 A.硫蒸气变化为硫固体为放热过程;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C.H2O(g)→H2O(l)为放热过程;
D.浓硫酸稀释过程中放出热量.
解答 解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol,故B错误;
C.H2O(g)→H2O(l)为放热过程,2molH2(g)和1mol O2(g)反应生成2mol H2O(l)时放出的热量多,即Q1>Q2,故C正确;
D.浓硫酸稀释过程中放出热量,所以放出的热量大于57.3kJ,故D错误;
故选C.
点评 本题考查反应热与焓变,题目难度不大,注意反应热的表示方法,易错点为D,注意浓硫酸溶于水放热的特点.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向CuSO4溶液中加入NaOH:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3?H2O2:Al3++4NH3?H2O2═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
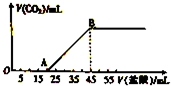 将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
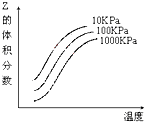
| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | X和Y中只有一种是气态,Z为气态 | D. | 上述反应的正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学组装了如图所示的电化学装置.电极Ⅰ为Al,其他电极均为Cu.
某同学组装了如图所示的电化学装置.电极Ⅰ为Al,其他电极均为Cu.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3通入BaCl2溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入MgCl2溶液中 | D. | Cl2通入KI淀粉溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com