
【题目】在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭器中,发生反应:I2(g)+H2(g)![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=______ mol·L-1,而c(HI)=________,所以化学反应速率________最大。(填v(正)或v(逆))。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____,而c(HI)_____ ,从而化学反应速率v(正) _______ (填减小、增大、不变)。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应达到了最大限度。若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率都将________。
【答案】a/V 0 v(正) 减小 增大 减小 相等 保持不变
【解析】
在化学平衡建立的过程中,开始时,c(H2)和c(I2)为最大值,正反应速率最大,由于此时没有HI,逆反应速率最小为0,随反应进行c(H2)和c(I2)逐渐减小,正反应速率逐渐减小,逆反应速率逐渐增大,直到平衡时,v正=v逆,反应体系中各组分的浓度、百分含量、各组分的分压等不发生变化。
(1)反应刚开始时,c(H2)=a/Vmol·L-1,为最大值,正反应速率最大,而c(HI)=0,逆反应速率最小为0,故答案为:a/V;0;v(正);
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)减小,而c(HI)增大,化学反应速率v(正)减小,v(逆))增大,故答案为:减小;增大;减小;
(3)当反应进行到v(正)与v(逆) 相等时,此可逆反应达到了最大限度。若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率都将保持不变,故答案为:相等;保持不变。


科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于特制的密闭真空容器中(容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
2NH3(g)+CO2(g)。实验测得不同温度下的部分平衡数据如下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列说法中不正确的是
A. 混合气体的平均相对分子质量——M不再随时间变化时反应达平衡状态
B. 15.0 ℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3
C. 该反应H>0,p2=2p1
D. 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1) 上述生产纯碱的方法称________________,副产品的一种用途为____________。
(2) 沉淀池中发生的化学反应方程式是____________________________________。
(3) 写出上述流程中X物质的分子式________________。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________________________________________________________。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的溶度恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量的比为( )
A.2:1B.2:3C.3:2D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
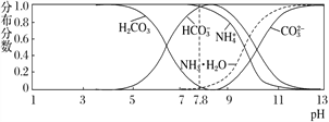
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知


以下是化合物N ( 属于环己烯酮类 ) 的两步合成路线,F不含氯元素。
I步:

II步:

请回答:
(1)D中官能团名称是_______________。
(2)下列说法不正确的是_________________。
A.E生成F与G生成H的反应类型相同 B.J的结构简式是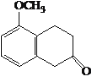
C.1mol I最多能和4mol H2加成 D.N的分子式为C17H20O2
(3)符合下列条件的G 的同分异构体有_____________________种,写出其中一种同分异构体的结构简式_________________。
①能与浓溴水反应产生白色沉淀②苯环上有两个取代基,且苯环上的一氯代物只有两种
③可在一定条件下发生水解反应和银镜反应
(4)写出方程式:B + C→D ________________________________________。
(5)以![]() 为原料,合成
为原料,合成 _______________________________________________________________ (用流程图表示,反应条件任选)。
_______________________________________________________________ (用流程图表示,反应条件任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取的溴约占世界溴年产量的1/3,从海水中提取溴的主要步骤可表示为( )。
A. 氧化→吸收→吹出B. 氧化→吹出→吸收
C. 吹出→氧化→吸收D. 吹出→吸收→氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
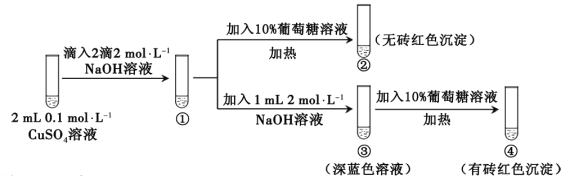
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com