
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gFe与0.5 molCl2充分反应转移电子数为1.5NA | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA | |
| D. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
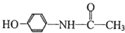 ,下列关于扑热息痛的描述正确的是( )
,下列关于扑热息痛的描述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 扑热息痛易溶于水 | |
| C. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
| D. | 属于芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com