
| A. | 稳定性:HI>HCl | B. | 熔、沸点:HI>HCl | ||
| C. | 同浓度的HI和HCl的酸性:HI>HCl | D. | 还原性:HI>HCl |
分析 共价键的键能越大,共价键越稳定,氢化物分子越稳定,分子晶体的熔沸点与相对分子质量有关.
解答 解:A.已知:H-Cl和H-I键能分别为431KJ/mol和297KJ/mol,H-Cl的键能大于H-I的键能,共价键的键能越大,共价键越稳定,所以稳定性:HCl>HI,故A错误;
B.分子晶体的熔、沸点与相对分子质量有关,与共价键的键能无关,故B错误;
C.共价键的键能越大,共价键越稳定,分子越难电离,所以同浓度的HI和HCl的酸性:HI>HCl,与键能有关,故C正确;
D.氢化物的还原性与失电子能力有关,与键能无关,故D错误.
故选C.
点评 本题考查了共价键的键能、分子晶体的熔沸点等,题目难度不大,注意把握共价键的键能对分子稳定性的影响,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
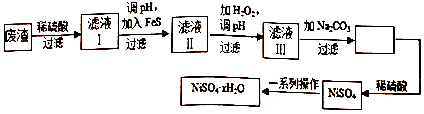
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
| 乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
| 乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |
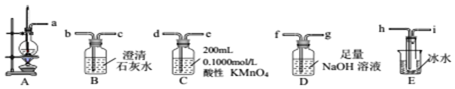
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:X<T<Z | ||
| C. | 气态氢化物的还原性:X<T<R | D. | 最高价氧化物的水化物酸性:Q<T<R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 检验操作 | 现象 | 结论 | |
| A | 加入盐酸酸化的氯化钡 | 产生白色沉淀 | 一定有 SO42- |
| B | 加入氯水与四氯化碳 | 有机层呈紫色 | 一定有 I- |
| C | 加入足量稀盐酸 | 产生无色气体 | 一定有 CO32- |
| D | 加入硝酸银 | 产生白色沉淀 | 一定有 Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C7H8与C6H6互为同系物 | |
| B. | 由乙酸与乙醇制备乙酸乙酯的反位属于加成反位 | |
| C. | C3H6Br2有4种同分异构体 | |
| D. | 油脂在人体内最终分解为甘油和高级脂肪酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com