【答案】
分析:由短周期主族元素A、B、C、D、E在元素周期表中的位置可知,B、C、D位于第二周期,则B为C,C为N,D为O,A为Al,E为Cl,
(1)同周期从左向右非金属性在增强;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO
4,二者发生氧化还原反应生成氯气、水、KCl;
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO
2,且剩余NO,被碱液吸收发生氧化还原反应;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+

O
2(g)=

Al
2O
3(s)△H=-aKJ/mol,②C(s)+O
2(g)=CO
2(g)△H=-bKJ/mol,
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO
2(g)=3C(s)+2Al
2O
3(s);
(5)与D同主族且相邻的元素的非金属为S,利用单质之间的置换反应可证明S和Cl的非金属性强弱.
解答:解:由短周期主族元素A、B、C、D、E在元素周期表中的位置可知,B、C、D位于第二周期,则B为C,C为N,D为O,A为Al,E为Cl,
(1)同周期从左向右非金属性在增强,则非金属性为O>N>C,故答案为:O>N>C;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO
4,二者发生氧化还原反应生成氯气、水、KCl,该反应为8HCl+KClO
4
KCl+4Cl
2↑+4H
2O,
故答案为:8HCl+KClO
4
KCl+4Cl
2↑+4H
2O;
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO
2,且剩余NO,且二者等量,被碱液吸收发生氧化还原反应为NO+NO
2+2NOH=2NaNO
2+H
2O,
则该盐为NaNO
2,故答案为:NaNO
2;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+

O
2(g)=

Al
2O
3(s)△H=-aKJ/mol,②C(s)+O
2(g)=CO
2(g)△H=-bKJ/mol,
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO
2(g)=3C(s)+2Al
2O
3(s),其反应热△H=(-aKJ/mol)×4-(-bKJ/mol)×3=-(4a-3b)KJ/mol,
故答案为:-(4a-3b)KJ/mol;
(5)与D同主族且相邻的元素的非金属为S,则将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成可证明S和Cl的非金属性强弱,故答案为:将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成.
点评:本题考查位置、结构、性质的应用,明确元素的位置判断出元素是解答本题的关键,并熟悉非金属性的比较方法、氧化还原反应、盖斯定律计算反应热等高考常考考点即可解答,题目难度中等,(3)为解答的难点.

 O2(g)=
O2(g)= Al2O3(s)△H=-aKJ/mol,②C(s)+O2(g)=CO2(g)△H=-bKJ/mol,
Al2O3(s)△H=-aKJ/mol,②C(s)+O2(g)=CO2(g)△H=-bKJ/mol, KCl+4Cl2↑+4H2O,
KCl+4Cl2↑+4H2O, KCl+4Cl2↑+4H2O;
KCl+4Cl2↑+4H2O; O2(g)=
O2(g)= Al2O3(s)△H=-aKJ/mol,②C(s)+O2(g)=CO2(g)△H=-bKJ/mol,
Al2O3(s)△H=-aKJ/mol,②C(s)+O2(g)=CO2(g)△H=-bKJ/mol,

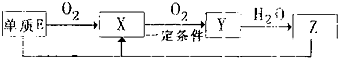
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2 2NO2
2NO2