

| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |


科目:高中化学 来源: 题型:
| A、乙醇燃烧是生成物总能量高于反应物总能量的反应 | ||
| B、稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol可表示稀硫酸与稀Ba(OH)2溶液反应的中和热为△H=-57.3 kJ/mol | ||
| C、2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-QkJ/mol可以表示H2S的燃烧热. | ||
D、高温下,某反应达到平衡,平衡常数为K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应必然伴随发生能量变化 |
| B、化学变化中的能量变化主要是由化学键变化引起的 |
| C、能量变化是化学反应的基本特征之一 |
| D、化学变化中能量变化的大小与反应物的质量的多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
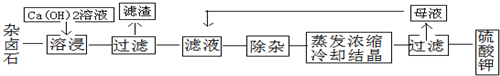

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com