
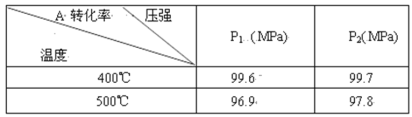
【题目】可逆反应2A(g)+B(g)![]() 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是
A.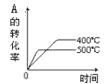 B.
B.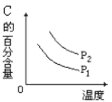
C.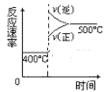 D.
D.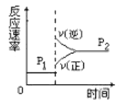
【答案】D
【解析】
根据表格可知:在相同的压强下,升高温度,A的转化率降低。说明升高温度平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向是吸热反应,所以正反应为放热反应。在相同的温度下,增大压强,A的转化率增大。说明增大压强化学平衡正向移动。即该反应的正反应是一个气体体积减小的放热反应。
A.升高温度,A的含量降低,,证明升高温度,化学平衡向逆反应方向移动,选项A正确;
B.升高温度,C的含量降低,说明升高温度平衡向逆反应方向移动,选项B正确;
C.升高温度,V正、V逆 都增大,但吸热反应方向增大的多,即V逆>V正,所以平衡逆向移动,经过一段时间反应达到平衡,选项C正确;
D.当反应达到平衡后,增大压强,V正、V逆 都增大,但反应物的浓度增大的多,生成物的浓度增大的少,所以V正>V逆,平衡正向移动,最终达到新的平衡状态,选项D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为2∶1的是 ( )
A.在反应2FeCl3+Fe =3FeCl2中还原产物与氧化产物的质量
B.相同温度下,0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)△H=+100kJ/mol的能量变化如图所示,判断下列叙述中正确的是

A. 加入催化剂,该反应的反应热△H将减小
B. 每生成2molA-B键,将吸收bkJ能量
C. 每生成2分子AB吸收(a-b)kJ能量
D. 该反应正反应的活化能大于100kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )

A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是
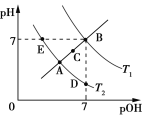
A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X),δ(X)随pH的变化如图所示。下列叙述错误的是( )

A.Ka2(H3PO4)的数量级为10-8
B.Kh(HPO42-)=1.0×10-6.8
C.pH=7时c(H2PO4-)>c(HPO42-)
D.NaH2PO4溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的化学用语不正确的是( )
实验 | 解释 | |
A | 25℃0.1mol/L盐酸溶液pH=1 | H2O=H++OH- |
B | 25℃0.1mol/L的NH3·H2OpH=11 | NH3·H2O |
C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O |
D | 向0.1mol/LNa2CO3溶液中滴加酚酞试液后溶液变红 | CO32-+H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应2Mg+CO2![]() 2MgO+C ΔH<0从熵变角度看,可自发进行
2MgO+C ΔH<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7, Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com