
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
分析 该反应中Cl元素化合价由+5价、-1价变为0价,有$\frac{1}{6}$的HCl不作还原剂,起酸的作用,氧化剂是K35ClO3、还原剂 H37Cl,据此分析解答.
解答 解:A.HCl→KCl时Cl元素化合价不变,HCl起酸的作用,所以KCl中含有37Cl,故A错误;
B.生成氯气的相对分子质量=$\frac{35×1+37×5}{3}$=73.3,故B正确;
C.该反应转移的电子数为5e-,则1molK35ClO3参加反应,得到电子数为5NA,故C错误;
D.氧化剂是K35ClO3、还原剂是$\frac{5}{6}$的 H37Cl,所以氧化剂和还原剂的物质的量之比为1:5,故D错误;
故选B.
点评 本题考查了氧化还原反应,明确元素化合价转化是解本题关键,易错点是氯气相对分子质量的计算方法,题目难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 | |
| D. | 研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
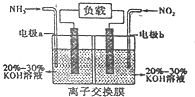
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
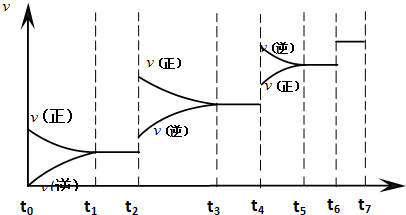
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
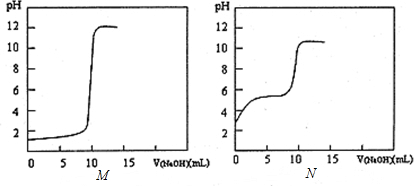
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | 试剂 | 现象 |
| ①淀粉 ②苯乙烯 ③苯酚 ④蛋白质 | a.浓硝酸 b.酸性高锰酸钾溶液 c.碘水 d.FeCl3溶液 | A.呈紫色 B.呈蓝色 C.紫色褪去 D.呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com