


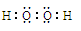 Na2SO3
Na2SO3 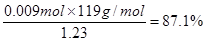
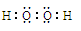 。在装置Ⅰ中发生反应NaClO3把Na2SO3氧化为Na2SO4,它本身被还原为ClO2.所以还原剂是Na2SO3。(2)在装置Ⅱ中中发生反应:ClO2+H2O2+NaOH=NaClO2+H2O+O2↑.Na2SO4溶液在装置Ⅲ电解池发生氧化还原反应:溶液中的阳离子的氧化性:H+>Na+,所以在阴极发生反应:2H++2e-=H2↑.由于破坏了附近的水的电离平衡,最终导致该区域的溶液显碱性,分离出NaOH溶液。溶液中的阴离子的还原性:OH->SO42-,所以在阳极发生反应为:4OH—+4e-=O2↑+2H2O。消耗了水电离产生的OH-,破坏了水的电离平衡,水继续电离。最终导致该区域的溶液显酸性。因此该阳极区产生的是氧气产物A为硫酸。化学式是H2SO4。n(O2)=" 11.2L÷" 22.4L/mol =0.5mol.则n(e-)=4×0.5mol=2mol.则理论上通过电解池的电量为2mol×9.65×l 04C/ mol=" 1.93×l" 05C.(3)装置Ⅱ中反应的化学方程式为ClO2+ H2O2+NaOH=NaClO2+H2O+O2↑的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O。(4)在反应过程中发生的反应为Sn2++ 2Fe3+= Sn4++ 2Fe2+, 6Fe2++Cr2O72- +14H+= 6Fe3++2Cr3++ 7H2O 。由方程式得关系式为:6Fe2+ ~ 3Sn2+ ~ Cr2O72–。n(Cr2O72-)= 0.200mol/L× 0.01500L=0.003mol.,所以n(Sn)="0.009" mol.m(Sn)=" 0.009" mol×119g/mol=1.071g.所以样品中锡的质量分数W%=
。在装置Ⅰ中发生反应NaClO3把Na2SO3氧化为Na2SO4,它本身被还原为ClO2.所以还原剂是Na2SO3。(2)在装置Ⅱ中中发生反应:ClO2+H2O2+NaOH=NaClO2+H2O+O2↑.Na2SO4溶液在装置Ⅲ电解池发生氧化还原反应:溶液中的阳离子的氧化性:H+>Na+,所以在阴极发生反应:2H++2e-=H2↑.由于破坏了附近的水的电离平衡,最终导致该区域的溶液显碱性,分离出NaOH溶液。溶液中的阴离子的还原性:OH->SO42-,所以在阳极发生反应为:4OH—+4e-=O2↑+2H2O。消耗了水电离产生的OH-,破坏了水的电离平衡,水继续电离。最终导致该区域的溶液显酸性。因此该阳极区产生的是氧气产物A为硫酸。化学式是H2SO4。n(O2)=" 11.2L÷" 22.4L/mol =0.5mol.则n(e-)=4×0.5mol=2mol.则理论上通过电解池的电量为2mol×9.65×l 04C/ mol=" 1.93×l" 05C.(3)装置Ⅱ中反应的化学方程式为ClO2+ H2O2+NaOH=NaClO2+H2O+O2↑的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O。(4)在反应过程中发生的反应为Sn2++ 2Fe3+= Sn4++ 2Fe2+, 6Fe2++Cr2O72- +14H+= 6Fe3++2Cr3++ 7H2O 。由方程式得关系式为:6Fe2+ ~ 3Sn2+ ~ Cr2O72–。n(Cr2O72-)= 0.200mol/L× 0.01500L=0.003mol.,所以n(Sn)="0.009" mol.m(Sn)=" 0.009" mol×119g/mol=1.071g.所以样品中锡的质量分数W%=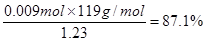 。(5)电解精炼Sn时,用粗Sn作阳极,精Sn作阴极。含Sn2+离子的溶液作电解质溶液。所以b极为阳极。阳极电极反应式Sn -2e-=Sn2+;Zn-2e-=Zn2+。阴极电极反应式为:Sn2++2e-=Sn。即相当于一部分的Sn是Zn发生置换反应Zn+Sn2+=Zn2++Sn。阳极每有65gZn反应,阴极生成Sn119g,溶液减轻54g.现在溶液减轻0.54g,则发生反应的Zn为0.01mol,其质量为0.65g,由该Zn置换出来的Sn为0.01mol。其质量为1.19g.所以参加反应的锡质量为11.90-1.19= 10.71g,因为Sn的含量为87.1%,所以Sn合金的质量为10.71g÷87.1%=12.3g.
。(5)电解精炼Sn时,用粗Sn作阳极,精Sn作阴极。含Sn2+离子的溶液作电解质溶液。所以b极为阳极。阳极电极反应式Sn -2e-=Sn2+;Zn-2e-=Zn2+。阴极电极反应式为:Sn2++2e-=Sn。即相当于一部分的Sn是Zn发生置换反应Zn+Sn2+=Zn2++Sn。阳极每有65gZn反应,阴极生成Sn119g,溶液减轻54g.现在溶液减轻0.54g,则发生反应的Zn为0.01mol,其质量为0.65g,由该Zn置换出来的Sn为0.01mol。其质量为1.19g.所以参加反应的锡质量为11.90-1.19= 10.71g,因为Sn的含量为87.1%,所以Sn合金的质量为10.71g÷87.1%=12.3g.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
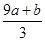 ) mol
) mol| A.①④ | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )| A.反应中Al2(SO4)3被氧化 |
| B.Al2 (SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.x=0.5,a=8 | B.x=0.5,a=10 |
| C.x=1.5,a=8 | D.x=1.5,a=10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4在反应中作氧化剂 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 |
| D.1 mol KClO3参加反应时有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: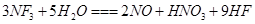 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是A. 是还原剂 是还原剂 |
B. 非极性分子,在潮湿空气中泄漏会看到红棕色气体 非极性分子,在潮湿空气中泄漏会看到红棕色气体 |
| C.每消耗0.2mol氧化剂,可收集到5.418L气体 |
D.若生成1mol  个电子 个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com