
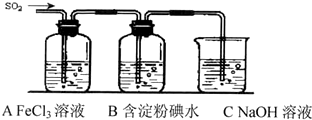
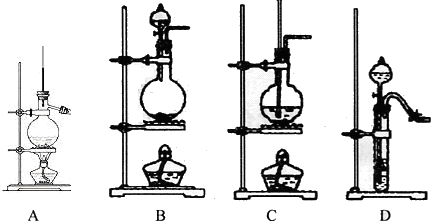
分析 根据离子反应方程式得出Fe2+,根据物质的量之比等于计量数之比得出1:2;实验室制取气体要考虑操作方便、易控制、不能含杂质;有毒气体不能直接排空,要有尾气处理装置,装置中的物质与尾气极易发生反应;根据实验步骤回顾所需仪器;二氧化硫具有还原性,和氧化剂能发生氧化还原反应,能使高锰酸钾溶液、含碘的淀粉溶液褪色,现象明显,
(1)反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以还原产物是Fe2+,参加反应的SO2和Fe3+的物质的量之比是1:2;
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫;
B、浓硫酸虽具有强氧化性,但不能氧化亚硫酸钠,和亚硫酸钠发生复分解反应生成SO2;
C、固体硫在纯氧中燃烧,操作不容易控制;
D、铜和浓硫酸在加热条件下可以制得二氧化硫.
(3)二氧化硫是酸性氧化物,具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以装置C的作用是吸收SO2尾气,防止污染空气;
(4)操作步骤:蒸发需用到蒸发皿,冷却结晶需用到烧杯,过滤需用到漏斗、玻璃棒,故不需要石棉网和坩埚.
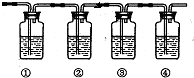
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色.
(6)I2+SO2+2H2O=2HI+H2SO4;二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性
解答 解:(1)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,SO2气体还原Fe3+生成的还原产物是Fe2+,参加反应的SO2和Fe3+的物质的量之比等于计量数之比为1:2,
故答案为:Fe2+;1:2;
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错误;
B、浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,和亚硫酸钠发生复分解反应生成二氧化硫气体,故B正确;
C、固体硫在纯氧中燃烧,操作不容易控制,故C错误;
D、Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,可以制备得到二氧化硫气体,故D正确,
故选BD,
故答案为:BD;
(3)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以装置C的作用是吸收SO2尾气,防止污染空气,
故答案为:吸收SO2尾气,防止污染空气;
(4)操作步骤:蒸发需用到A 蒸发皿,E.玻璃棒,冷却结晶需用到烧杯,过滤需用到C.漏斗,D.烧杯,E.玻璃棒,故不需要B.石棉网、F.坩埚,
故答案为:BF;
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色,
故答案为:方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色;
(6)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,故答案为:B中蓝色溶液褪色.
点评 本题考查的是二氧化硫的性质及实验室制法,二氧化硫有还原性,与强氧化剂发生氧化还原反应,还具有漂白性,经常与次氯酸的漂白性比较,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 的AlCl3溶液中,含Al3+数小于NA | |
| B. | 标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| C. | 1mol NaBH4中含的离子的数目为6NA | |
| D. | 30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T温度下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T温度下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
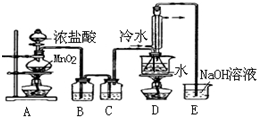 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置图 |  | 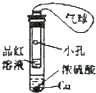 |  | 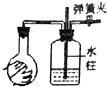 |
| 实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
| 实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA | |
| C. | 常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA | |
| D. | 在1 L 1.0 mol•L-1碳酸钠溶液中,阴离子总数大于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com