
下列物质中,跟酸性高锰酸钾溶液、溴水、碳酸氢钠溶液、新制氢氧化铜都能发生反应的是
[ ]
A.乙烯 B.苯酚 C.丙烯酸 D.丁烯醛
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:南海中学2007届高三年级模底考试、化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市六校高三第二次联考化学试卷(解析版) 题型:填空题
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
|
|
亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
|
熔点 |
271℃ |
801℃ |
|
沸点 |
320℃会分解 |
1413℃ |
|
跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:填空题
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下:
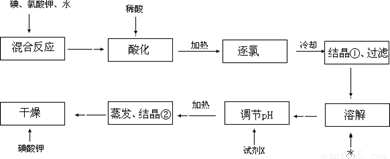
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是 。
(2)X的化学式为 ;写出用试剂X调节pH的化学方程式: 。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响? 。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol·L-1的H2SO4,振荡。 |
溶液变蓝色 |
①推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知-NH2连在苯环上显碱性,![]() 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
(A)既有酸性又有碱性__________________________;
(B)只有酸性_____________________________;
(C)只有碱性_____________________________;
(D)显中性______________________________。
由于-COOH能跟-NH2形成![]() ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n]。该化合物为高强度纤维材料,其结构简式为___________________________________。
,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n]。该化合物为高强度纤维材料,其结构简式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
①某元素原子的最外层只有一个电子,它跟卤素结合时,一定形成离子键
②离子化合物一定含有离子键,则共价化合物中一定不含有离子键
③VIIA族单质从上到下,熔沸点越来越高,则IA族单质的熔沸点也越来越高
④H2O分子间存在着氢键,故H2O分子比H2S分子稳定
⑤在熔融状态和水溶液中均不能导电的物质称为非电解质
⑥HClO4酸性比H2SO4酸性强,说明氯的非金属性比硫强
A.①②④ B.①③⑤ C.②⑥ D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com