
A、当稀硫酸与稀氨水恰好完全反应时,则c(OH-)+c(S
| ||||
B、当滴至溶液的pH=7时,则c(N
| ||||
C、当滴加的稀硫酸的体积为50ml时溶液成碱性,则c(N
| ||||
D、当滴加的稀硫酸的体积为200mL时,则c(H+)=c(OH-)+2c(NH3?H2O)+c(N
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用锌和稀硫酸反应制取氢气 |
| B、用氢气高温还原氧化铜得到单质铜 |
| C、用氯气和溴化钠溶液反应制取溴单质 |
| D、用碳和高温水蒸气反应制取氢气和一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
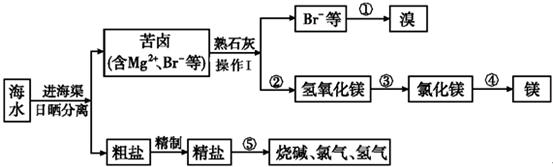
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | t/min C/mol?L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| B、石英只能用于生产光导纤维 |
| C、“地沟油”禁止食用,但可以用来制肥皂 |
| D、为了增加食物的营养成分,可以大量使用食品添加剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com