
| A. | 在 16g18O2中含有NA个氧原子 | |
| B. | 16gCH4中含有4NA个C-H 键 | |
| C. | 22g 某气体含分子数为 0.5NA,则其摩尔质量为 44 | |
| D. | 含 NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为 1 mol•L-1 |
分析 A.18O2的相对分子质量为36,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
B.甲烷分子中含有4个碳氢键,n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
C.摩尔质量的单位为g./mol;
D.溶于1L水中,所得溶液的体积不是1L.
解答 解:A.18O2的相对分子质量为36,n(18O2)=$\frac{16g}{36g/mol}$=$\frac{4}{9}$mol,则含有$\frac{8}{9}$mol18O原子,含有O的个数为$\frac{8}{9}$NA,故A错误;
B.16g甲烷的物质的量为1mol,1mol甲烷分子中含有4mol碳氢键,含有4NA个C-H 键,故B正确;
C.22g 某气体含分子数为 0.5NA,该气体的物质的量为0.5mol,其摩尔质量为:$\frac{22g}{0.5mol}$=44g/mol,故C错误;
D.含NA个Na+的Na2O溶解于1L水中,没有告诉溶于体积,无法计算钠离子的浓度,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;D为易错点,注意所得溶液体积不是1L.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 1molC8H18分子中含有的共用电子对数为26NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
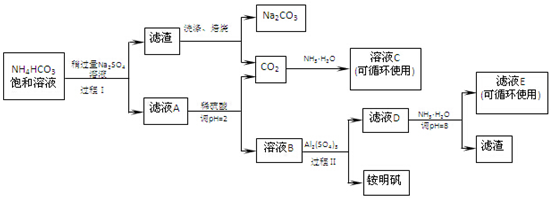
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
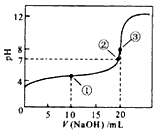 (1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.
(1)常温下,用0.1000mol/LNaOH溶液滴定20.00ml 0.1000mol/L CH3COOH溶液所得滴定曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a% | B. | $\frac{3}{4}$a% | C. | $\frac{6(1-a%)}{7}$ | D. | $\frac{12(1-a%)}{13}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com