
 短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题:
短周期元素A、B、C、D、E、F、G原子序数依次递增,已知A和D,C和G为同一主族元素,D形成的阳离子和C形成的阴离子具有相同的核外电子排布,B原子的最外层电子数比次外层多3,G形成的化合物甲是造成酸雨的主要原因,F和A可形成化合物FA4很不稳定,F与C形成的化合物是制造光导纤维的主要原料,E的最高价氧化物的水化物能溶解于D的最高价氧化物的水化物中.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图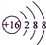
分析 短周期元素A、B、C、D、E、F、G原子序数依次递增,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F与C形成的化合物是制造光导纤维的主要原料,则C为O元素、F为Si;C和G为同一主族元素,则G为S元素;D形成的阳离子和C(氧)形成的阴离子具有相同的核外电子排布,D处于第三周期,A和D为同一主族元素,F(Si)和A可形成化合物FA4很不稳定,可推知A为H元素、D为Na;D的最高价氧化物的水化物为硫酸,E的最高价氧化物的水化物能溶解硫酸,E的原子序数介于Na、Si之间,则E为Al,G形成的化合物甲为SO2是造成酸雨的主要原因.
(1)E的最高价氧化物水化物为Al(OH)3,存在酸性电离与碱式电离;
(2)由C、D形成的一种淡黄色固体为Na2O2,由钠离子与过氧根离子构成,G离子为S2-,离子核外有18故电子,有3个电子层,构成电子数为2、8、8;
(3)E的最高价氧化物的水化物为Al(OH)3,D的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水;
(4)F和C形成的晶体为SiO2,属于原子晶体,微粒间的相互作用力是共价键;
(5)G形成的化合物甲为SO2,与MnO2反应生成MnSO4;
(6)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,晶体中n(SO42-):n(Al3+):n(NH4+)=0.02mol:0.01mol:0.01mol=2:1:1,故该晶体为NH4Al(SO4)2,
往该盐的水溶液中滴加氢氧化钡溶液时,NH4Al(SO4)2与氢氧化钡按物质的量1:2反应时生成沉淀质量达到最大值.
解答 解:短周期元素A、B、C、D、E、F、G原子序数依次递增,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F与C形成的化合物是制造光导纤维的主要原料,则C为O元素、F为Si;C和G为同一主族元素,则G为S元素;D形成的阳离子和C(氧)形成的阴离子具有相同的核外电子排布,D处于第三周期,A和D为同一主族元素,F(Si)和A可形成化合物FA4很不稳定,可推知A为H元素、D为Na;D的最高价氧化物的水化物为硫酸,E的最高价氧化物的水化物能溶解硫酸,E的原子序数介于Na、Si之间,则E为Al,G形成的化合物甲为SO2是造成酸雨的主要原因.
(1)E的最高价氧化物水化物为Al(OH)3,电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,
故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
(2)由C、D形成的一种淡黄色固体为Na2O2,其电子式为 ,G离子为S2-,离子结构示意图为
,G离子为S2-,离子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)E的最高价氧化物的水化物为Al(OH)3,D的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)F和C形成的晶体为SiO2,属于原子晶体,微粒间的相互作用力是共价键,
故答案为:共价键;
(5)G形成的化合物甲为SO2,化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,其反应的化学方程式:SO2+MnO2=MnSO4,
故答案为:SO2+MnO2=MnSO4;
(6)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,晶体中n(SO42-):n(Al3+):n(NH4+)=0.02mol:0.01mol:0.01mol=2:1:1,故该晶体为NH4Al(SO4)2,
往该盐的水溶液中滴加氢氧化钡溶液时,NH4Al(SO4)2与氢氧化钡按物质的量1:2反应时生成沉淀质量达到最大值,反应离子方程式为:Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O,
故答案为:NH4Al(SO4)2;Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O.
点评 本题考查结构性质位置关系应用、无机物推断等,侧重考查学生分析推理能力、知识迁移运用能力,(6)中关键是根据反应判断溶液中含有的离子,难度中等.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 按要求对图中两极进行必要的联接并填空:其中a.b为惰性电极
按要求对图中两极进行必要的联接并填空:其中a.b为惰性电极查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1的蔗糖溶液 | B. | 0.01mol•L-1的CaCl2溶液 | ||
| C. | 0.02mol•L-1的NaCl溶液 | D. | 0.02mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应,A、B、C都可以被强还原剂还原成为D(C6H14O6).下面的说法错误的是( )
如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应,A、B、C都可以被强还原剂还原成为D(C6H14O6).下面的说法错误的是( )| A. | 果糖与A属于同分异构体 | B. | A在酒化酶催化下能产生C2H5OH | ||
| C. | B和C都属于糖类 | D. | D是1,2,3,4,5,6-己六醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属锰在冶金工业和钢铁工业中均有重要作用.可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
金属锰在冶金工业和钢铁工业中均有重要作用.可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )| A. | M是电源的负极 | |
| B. | 右侧气孔逸出的气体为O2 | |
| C. | 阳极发生氧化反应 | |
| D. | 电解槽中发生的总反应为MnSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$MnO2+H2↑+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | H2SO4═H2++SO42- | D. | Ba(OH)2═Ba2++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com