
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
分析 Cu与硝酸反应生成硝酸铜、N的氧化物和水,气体由导管过盛有蒸馏水的洗气瓶充分反应后最终收集气体为NO,整个过程中Cu失去电子数等于N得到电子数,以此来解答.
解答 解:整个过程中Cu失去电子数等于N得到电子数,由电子守恒可知,n(NO)=$\frac{\frac{9.6g}{64g/mol}×(2-0)}{(5-2)}$=0.1mol,理论上从洗气瓶出气口收集到气体(S.T.P)的体积为0.1mol×22.4L/mol=2.24L,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
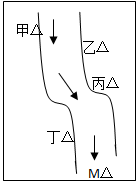 在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.
在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为Mg-2e-═Mg2+ | |
| B. | 负极可能会发生副反应Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 电池放电时Cl-由负极向正极迁移 | |
| D. | 正极反应式为AgCl+e-═Ag+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
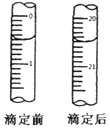 检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
检测血液中的Ca2+能够帮助判断多种疾病.某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
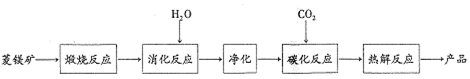
| 消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
| 物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| Ksp | 10-11 | 10-39 | 10-17 | 10-14 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2S | B. | SO2 | C. | SO2、O2 | D. | SO2、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
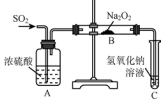 (1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:
(1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
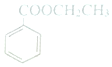
| A. | 分子式为C9H10O2 | |
| B. | 能发生取代、加成反应 | |
| C. | 苯环上的一氯代物有3种 | |
| D. | 在酸性条件下水解产物均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:实验题
请从图中选用必要的装置进行电解饱和食盐水(含酚酞)的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

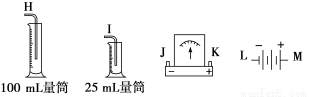
(1) A极发生的电极反应式是__________;B极发生的电极反应式是_______________
(2)电极A可能观察到的 现象是_________________
现象是_________________
(3)设计检测上述气体实验装置时,各接口的正确连接顺序为_______接_______、_______接A,B接_______、_______接_______。
(4)实验中,在盛有KI?淀粉溶液的容器中发生反应的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com