
一定质量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(液)+3O2(气)=XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
(1)反应前O2体积是 。 (2)化合物XY2的摩尔质量是 。
(3)若XY2分子中X、Y两种元素的质量比是3∶16 。则X、Y两种元素分别为
和 。(写元素符号)。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的液态化合物XY2,在一定质量的O2中恰好完全燃烧,化学方程式为XY2(l)+3O2(g)=XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g/L。
(1)反应前O2的体积是 mL。
(2)化合物XY2的摩尔质量是 g/mol。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为 和 。(写元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(液)+3O2(气)=XO2(气)+2YO2(气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
(1)反应前O2体积是 。 (2)化合物XY2的摩尔质量是 。
(3)若XY2分子中X、Y两种元素的质量比是3∶16 。则X、Y两种元素分别为
和 。(写元素符号)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省上饶市高三第一次月考化学试卷(解析版) 题型:填空题
(本题共12分)
Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) = N2O4(l) ΔH1=-19.5kJ∙mol-1
②N2H4(l) + O2 (g)=N2(g)+2H2O(g) ΔH2 =-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
Ⅱ、一定质量的液态化合物 在标准状况下的一定质量的
在标准状况下的一定质量的 中恰好完全燃烧,反应方程式为:
中恰好完全燃烧,反应方程式为: 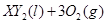 ===
===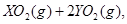 冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56
冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56  则:
则:
(1)反应前 的体积是
。
(2)化合物
的体积是
。
(2)化合物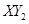 的摩尔质量是
。
的摩尔质量是
。
(3)若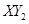 分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为
和
(写元素符号)。
分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为
和
(写元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com