
【题目】下列解释事实的方程式不正确的是
A.焊接铁轨: 2Fe + Al2O3![]() 2Al + Fe2O3
2Al + Fe2O3
B.工业固氮: N2 + 3H2![]() 2NH3
2NH3
C.用纯碱除油污:CO32-+H2O![]() HCO3-+ OH-
HCO3-+ OH-
D.用湿润的淀粉KI试纸检验Cl2:Cl2 + 2I-=2Cl-+I2
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应aX(g) ![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c
B. 达到新平衡时,物质X的转化率减小
C. 压缩容器的容积时,υ正增大,υ逆减小
D. 达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]是制备稀土发光材料、汽车尾气净化催化剂的重要原料。碳酸铈可由铈的氯化物和碳酸氢铵反应制备。甲同学利用下列装置模拟制备Ce2(CO3)3:
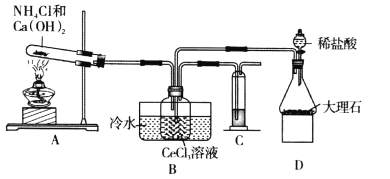
已知:i.装置C中溶液为亚硫酸钠溶液;
ii.Ksp[Ce2(CO3)3]=1.00×10-28;
iii.Ce3+易被空气氧化成Ce4+。
(1)装置D中盛放稀盐酸的实验仪器名称为________,装置C中溶液的作用是________。
(2)装置A中发生的化学反应方程式为________。
(3)实验装置中有一处不合理,请针对不合理之处写出改进措施:________。
(4)装置B中制备Ce2(CO3)3反应的离子方程式为________。
(5)实验过程中当Ce3+沉淀完全时![]() ,溶液中
,溶液中![]() 为________。
为________。
(6)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到产品。检验产品是否洗涤干净的方法为________。
(7)为测定产品中Ce2(CO3)3的纯度,取![]() 产品加入稀硫酸、
产品加入稀硫酸、![]() 溶液至全部溶解,配成
溶液至全部溶解,配成![]() 溶液,取
溶液,取![]() 溶液用
溶液用![]() 的
的![]() 溶液滴定至终点(铈被还原成Ce3+),消耗
溶液滴定至终点(铈被还原成Ce3+),消耗![]() 溶液
溶液![]() ,则产品中Ce2(CO3)3的纯度为________。
,则产品中Ce2(CO3)3的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态亚硝酸(HNO2或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数Ka=6.0×10﹣6,其电离方程式为________。
(2)亚硝酸分子中各原子最外层电子均达到稳定结构,其电子式为________。
(3)亚硝酸进入人体可以与二甲胺[(CH3)2NH]迅速反应生成亚硝酸胺[CH3)2N-N=O],亚硝酸胺是最重要的化学致癌物之一。
① 亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+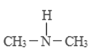
![]()
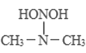
![]()
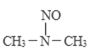
过程ⅰ和过程ⅱ的反应类型分别为:________、消去反应。
② 上述反应机理的反应过程与能量变化的关系如图:
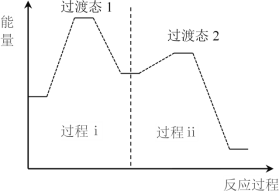
亚硝酸与二甲胺反应生成亚硝酸胺的反应ΔH________0(填“>”或“<”)。反应难度更大的是过程________(填“ⅰ”或“ⅱ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
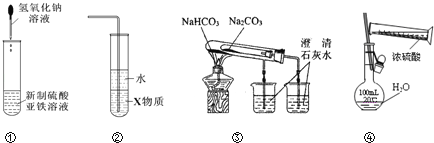
A.利用装置①可制备氢氧化亚铁并长时间观察其颜色
B.装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸
C.装置③验证Na2CO3和NaHCO3两种固体的热稳定性
D.通过④的方法配制一定浓度的稀硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
D.硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的锌碘单液流电池,其原理如下图所示。下列说法不正确的是 ( )。
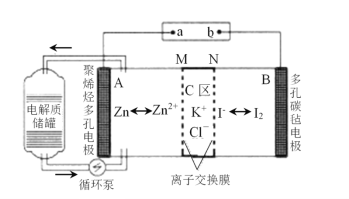
A.放电时B电极反应式为:I2+2e-=2I-
B.M为阳离子交换膜,N为阴离子交换膜
C.充电时,A极增重65g时,C区增加离子数为4NA
D.放电时电解质储罐中离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
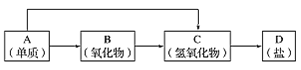
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为_____,A与FeCl3溶液反应的离子方程式________________________。
(2)写出一个“C→D”转化的化学方程式_________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将标况下22.4 mL HCl气体溶于1 L水可配成浓度为1![]() 10-3mol·L-1的盐酸
10-3mol·L-1的盐酸
B.一定条件下,1 mol Fe与1 mol Cl2充分反应,Fe失去的电子数目为3NA
C.标准状况下,22.4 L H2O所含的水分子数目为NA
D.500 mL 1 mol·L-1 MgCl2溶液中所含有Cl-浓度为2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com