
��A��

�� ������Ԫ�����ڱ��л�������Ԫ����ǽ���Ԫ�صķֽ���
�� ����NaH�Ĵ��ڣ���������ɰ���Ԫ�ط���VIIA�壬��ô�������������������۵ľ���ֵ��ȣ��ֿɰ���Ԫ�ط������ڱ��е�____________�塣
�� ���мס�������Ԫ�أ���Ԫ��ԭ�Ӻ���3p�Dz�����5�����ӣ���Ԫ�ص���ɫ��ӦΪ��ɫ��
�� ��Ԫ�ط��Ž��ס�����Ԫ����д������Ԫ�����ڱ��ж�Ӧ��λ�á�
�� ��Ԫ������Ԫ����Ƚϣ��ǽ����Խ�ǿ����______________�������ƣ���
д��������֤�ý��۵�һ����ѧ��Ӧ����ʽ___________________________________��
��B��

�� ������Ԫ�����ڱ���ȫ���ǽ���Ԫ�ص�����Ϊ___________��
��a��A ��b��B ��c��C ��d��D
�� ������Ϊ�γɻ���������Ԫ�ز���IVA���̼Ԫ�أ�������һ�ֶ�����Ԫ�أ��������ѧ���Ļ�ѧ֪ʶ�ж���һԪ����______________��
�� ���мס������ֶ�����Ԫ�أ������£���Ԫ�ص��������Ũ���������У����涼�������ܵ�����Ĥ����Ԫ��ԭ�Ӻ���M���Ӳ���K���Ӳ��ϵĵ�������ȡ�
�� ��Ԫ�ط��Ž��ס�����Ԫ����д������Ԫ�����ڱ��ж�Ӧ��λ�á�
�� �ס�����Ԫ����Ƚϣ������Խ�ǿ����______________�������ƣ���
������֤�ý��۵�ʵ����_____________________________��
��a�����ڿ����з����Ѿõ�������Ԫ�صĿ�״���ʷֱ������ˮ��
��b����������Ԫ�صĵ��ʷ�ĩ�ֱ��ͬŨ�ȵ����ᷴӦ
��c����������Ԫ�صĵ��ʷ�ĩ�ֱ����ˮ���ã��������̪��Һ
��d���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
A����1���ԣ�2��IVA��3����.H2S+Cl2=S+2HCl
B����1��B��2��H��3��þ. bc
��������
���������A��1�����ڱ��н���Ԫ����ǽ���Ԫ�ؼ���һ�ֽ��ߣ��ֽ������Ϊ����Ԫ�أ��ֽ����ұ�Ϊ�ǽ���Ԫ�أ���ͼ��ʾ
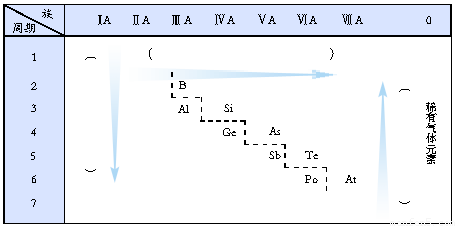
�ֽ��߸�����Ԫ�ش��ܱ���һ���Ľ����ԣ����ܱ��ֳ�һ���ķǽ����ԡ�
��2���ڢ�A��Ҳ�ǵ���ۺ���ͼ۵ľ���ֵ��ȣ��ݴ˿�֪��Ԫ��Ҳ���Է��ڵڢ�A�塣
��3�����ݹ���ԭ����֪�������Ԫ��ԭ�Ӻ���3p�Dz�����5�����ӣ��������Ԫ�أ���Ԫ�ص���ɫ��ӦΪ��ɫ�����������Ԫ�ء�S��Clλ��ͬһ���ڣ��������ҷǽ���������ǿ��������Ԫ�صķǽ�����ǿ��SԪ�صġ����Ը��ݽ�ǿ��Ԫ�طǽ����������û�������Ԫ�صķǽ������ʣ���˷�Ӧ�Ļ�ѧ����ʽ��H2S+Cl2=S+2HCl��
B��1������Ԫ��ȫ���ǽ���Ԫ�أ����Դ�ѡB��
��2�����л����ж�������Ԫ�أ������γɻ������������ij���C�⣬����H��
��3����Ԫ�ص��������Ũ���������У����涼�������ܵ�����Ĥ�����Լ��Ƕ������е���Ԫ�أ���Ԫ��ԭ�Ӻ���M���Ӳ���K���Ӳ��ϵĵ�������ȣ�������þԪ�ء�ͬ�����������ң����������ͣ����Խ����Խ�ǿ����Mg���Ƚ�Ԫ�ؽ�����ǿ����һ�������ǣ�1����һ�������½���������ˮ��Ӧ�����׳̶Ⱥ;��ҳ̶ȡ�һ������£���ˮ��ӦԽ���ס�Խ���ң��������Խǿ��2����������ͬŨ���ᷴӦ�����׳̶Ⱥ;��ҳ̶ȡ�һ������£����ᷴӦԽ���ס�Խ���ң��������Խǿ��3����������������ˮ������Ե�ǿ��������Խǿ����Ԫ�صĽ�����Խǿ��4�����ݽ�������������Һ֮����û���Ӧ��һ���ǻ��ý����û������ý�����������ȷ�Ĵ�ѡbc��
���㣺�������ڱ��Ľṹ��Ԫ�������ɵ�Ӧ��
�������������ڻ�����֪ʶ�Ŀ��飬�ѶȲ����ص㿼��ѧ����Ԫ�����ڱ�����Ϥ�̶ȼ���Ա��и�Ԫ�����ʺ���Ӧԭ�ӽṹ�������Եݱ���ɵ���ʶ�����ճ̶ȡ�������ѧ�������ʽṹ�����ʹ�ϵ�Լ�����Ԫ�������ɽ�����廯ѧ�����������


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ����Ԫ�ø���ѧ������ѧ��10�·��¿���ѧ�Ծ� ���ͣ������
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
��1����1��0 mol CH4��2��0 mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��
CH4��g��+H2O��g�� CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
��֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min,
������H2��ʾ��ƽ����Ӧ����Ϊ_ ��
��ͼ�е�P1_ _P2���<������>����=������100��ʱƽ�ⳣ��Ϊ_  _��
_��
����������������ʱ�����¶ȣ��淴Ӧ���ʽ� _ _���������С�����䡱����
��2����ѹǿΪ0��1 MPa������, ��a mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g�� CH3OH��g��������
CH3OH��g��������
�ܸ÷�Ӧ�� ��H_ _0����S_ _0���<������>����=������
��H_ _0����S_ _0���<������>����=������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���_ _��
A�������¶�
B����CH3OH��g������ϵ�з������
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1mol CO��3mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ƶı��С�
| l ʵ���� | l T���棩 | l n ��CO��/n��H2�� | l P��MPa�� |
| l �� | l 150 | l 1/3 | l 0��1 |
| l �� | l _ _ | l _ _ | l 5 |
| l �� | l 350 | l _ _ | l 5 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�����и�������ѧ��ĩͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ�������
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
CH4(g)+H2O(g) CO(g)+3H2(g)������ CO(g)+2H2(g)
CO(g)+3H2(g)������ CO(g)+2H2(g) CH3OH(g)
������
CH3OH(g)
������
��1����1.0 mol CH4��2.0 mol H2O(g)ͨ���ݻ�Ϊ100L��Ӧ�ң���һ�������·�����ӦI��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��

����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1 P2���<������>����=������100��ʱƽ�ⳣ����ֵΪ ��
��2����ѹǿΪ0.1 MPa������, ��a mol CO�� 3a mol H2�Ļ�������ڴ��������£��Է���Ӧ�����ɼ״���
�۸÷�Ӧ�ġ�H 0���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1mol CO��3mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
|
ʵ���� |
T(��) |
n(CO)/n(H2) |
P��Mpa�� |
|
i |
150 |
1/3 |
0.1 |
|
ii |
|
|
5 |
|
iii |
350 |
|
5 |
a�������ϱ��ո�������ʣ���ʵ���������ݡ�
b�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������5MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ��������ѹǿ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ������ѧ��10�·��¿���ѧ�Ծ� ���ͣ������
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
��1����1��0 mol CH4��2��0 mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��
CH4��g��+H2O��g�� CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO��g��+3H2��g��������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��

��֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min,
������H2��ʾ��ƽ����Ӧ����Ϊ_ ��
��ͼ�е�P1_ _P2���<������>����=������100��ʱƽ�ⳣ��Ϊ_ _��
����������������ʱ�����¶ȣ��淴Ӧ���ʽ� _ _������� ����С�����䡱����
��2����ѹǿΪ0��1 MPa������,
��a mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��  CH3OH��g�� ������
CH3OH��g�� ������
�ܸ÷�Ӧ�ġ�H_ _0����S_ _0���<������>����=������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���_ _��
A�������¶�
B����CH3OH��g������ϵ�з������
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1mol CO��3mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ƶı��С�
|
l ʵ���� |
l T���棩 |
l n ��CO��/n��H2�� |
l P��MPa�� |
|
l �� |
l 150 |
l 1/3 |
l 0��1 |
|
l �� |
l _ _ |
l _ _ |
l 5 |
|
l �� |
l 350 |
l _ _ |
l 5 |

A�������ϱ��ո�������ʣ���ʵ���������ݡ�
B�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������0��1MPa��5MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ���������������ߵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ�������Ĵ�ģ�⿼�Ի�ѧ���� ���ͣ������
��12�֣��״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
��1����1.0 mol CH4��2.0 mol H2O(g)ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��
CH4(g)+H2O(g) CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
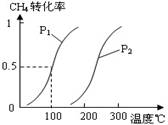
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min,����H2��ʾ��ƽ����Ӧ����Ϊ ��
��ͼ�е�P1 P2���<������>����=������100��ʱƽ�ⳣ��Ϊ ��
���������������������½����¶ȣ��淴Ӧ���ʽ� (���������С�����䡱)��
��2����ѹǿΪ0.1 MPa������, ��a
mol CO�� 3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO(g)+2H2(g)  CH3OH(g) ������
CH3OH(g) ������
�ܸ÷�Ӧ�ġ�H 0����S 0(�<������>����=��)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1mol CO��3mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
|
ʵ���� |
T(��) |
n (CO)/n(H2) |
P(MPa) |
|
�� |
150 |
1/3 |
0.1 |
|
�� |
|
|
5 |
|
�� |
350 |
|
5 |
A�������ϱ��ո�������ʣ���ʵ���������ݡ�
B�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������0.1MPa��5MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ���������������ߵ�ѹǿ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com