
【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O35H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称_____________,步骤④中洗涤时,为了减少产物的损失的试剂可以是_______
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因_____________
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论_____________
(4)测定产品纯度
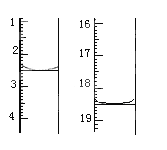
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000molL﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为_______mL,产品的纯度为_______%
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为________。
【答案】蒸馏烧瓶 乙醇 S2O32-+ 2H+= S + SO2↑+H2O 取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,反之,不含。 16.00 79.36 偏低 S2O32-+ 4Cl2+ 5H2O =2SO42-+ 8Cl-+ 10H+
【解析】
本实验利用模拟工业硫化碱法制取硫代硫酸钠,涉及SO2的实验室制法和用氢氧化钠溶液吸收SO2的尾气,重点考查了产物的提纯及纯度的分析,可以运用冷却结晶的方法从混合液中获得晶体,再通过水洗和乙醇的洗澡干燥获得成品,最后利用滴定的方法测定纯度,涉及原理、误差分析和数据处理,据此解答问题;
(1)由仪器结构特征,可知A为蒸馏烧瓶;由题目信息可知,硫代硫酸钠易溶于水、难溶于乙醇,应用乙醇洗涤,减少因溶解导致损失;
(2)Na2S2O3在酸性条件下会反应生成S和二氧化硫;
(3)加入盐酸,Na2S2O3反应生成S沉淀,静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
(4)根据图示的滴定管中液面读出初读数、终读数,然后计算出消耗碘的标准溶液体积,根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后碘单质的物质的量计算出Na2S2O35H2O质量及产品的纯度,若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,说明反应物没有完全反应,还需继续滴加标准液,产生误差;
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,反应生成硫酸钠、氯化钠,配平书写离子方程式。
(1)仪器A为蒸馏烧瓶,根据题意,硫代硫酸钠易溶于水,难溶于乙醇,因此为了减少产物的损失用乙醇进行洗涤;
(2)硫代硫酸钠与酸反应,S2O32-+ 2H+="=" S + SO2↑+H2O;
(3)取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,若不出现白色沉淀,说明不含硫酸钠杂质;
(4)①根据图2,滴定前的读数是2.50mL,滴定后读数是18.50mL,因此消耗碘的体积为(18.50-2.50)mL = 16.00mL,根据离子反应方程式,n(Na2S2O3) =16.00× 10-3× 0.1000 × 2mol =" 3.2" × 10-3mol,m(Na2S2O3·5H2O) =3.2× 10-3× 248g = 0.7936g,纯度为0.7936/1 × 100% = 79.36%;
②局部变色,说明消耗I2的量减少,求的纯度偏低;
(5)根据信息,氯气作氧化剂,转变成Cl-,Na2S2O3作还原剂,被氧化成SO42-,利用化合价的升降法进行配平,其离子反应方程式为:S2O32-+ 4Cl2+ 5H2O = 2SO42-+ 8Cl-+ 10H+。


科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是 ( )
A. 升高温度水的离子积增大
B. 镁条与氯化铵溶液反应生成氢气
C. 碳酸钙与稀盐酸反应生成二氧化碳
D. 加入少量硫酸铜可增大锌与稀硫酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氯酸钾能氧化Ag、Zn等金属。从一种银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() 中提取Ag、Cu及Pb的工艺流程如下:
中提取Ag、Cu及Pb的工艺流程如下:
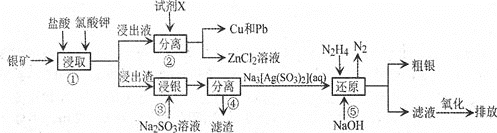
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________![]() 写出两种即可
写出两种即可![]() 。
。
![]() 步骤
步骤![]() 试剂X为________
试剂X为________![]() 填化学式,下同
填化学式,下同![]() ;步骤
;步骤![]() 滤渣的成分为________。
滤渣的成分为________。
![]() 步骤
步骤![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
![]() 步骤
步骤![]() 发生反应的离子方程式为________;其中
发生反应的离子方程式为________;其中![]() 肼
肼![]() 的电子式为________。
的电子式为________。
![]() 还原后的“滤液”经氧化后,其中的溶质为________。
还原后的“滤液”经氧化后,其中的溶质为________。
![]() 粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。

②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

(1)沉淀A、B的成分分别是__________、__________;步骤②中的试剂a是__________;(以上均填化学式)
(2)试写出步骤③中发生反应的离子方式__________、__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
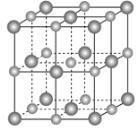
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
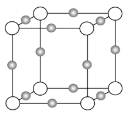
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。

(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。

推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨N2+3H2![]() 2NH3反应过程中的能量变化如图所示,据图回答下列问题:
2NH3反应过程中的能量变化如图所示,据图回答下列问题:

(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低________________,理由是___________________________________________。
(2)该反应的平衡常数表达式为:K=___________________,当浓度商Qc___K(填“<”、“>”或“=”)时,反应向右进行。
(3)450 ℃时该反应的平衡常数___500 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有___(填字母序号)。
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(g)+Y(g)![]() 2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是
2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是

A.加入催化剂B.增大压强
C.降低温度D.保持容器体积不变,冲入He气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com