
����Ŀ����ͼ�Dz�������Դ����������CO2ת��Ϊ������ʵ��CO2�Ĺ̶��ʹ������Ӧ�õ�װ�á���������ʹ��Li-CO2��������Ϊ���ɵ缫/CO2���͵�LiClO4-DMSO���Һ/�Ƭ������˵������ȷ����
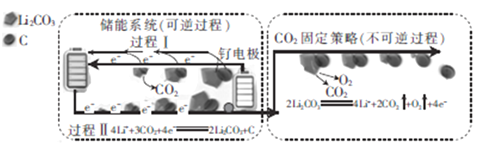
A. Li-CO2��صĵ��Һ��LiClO4��DMSO����ˮ�õ�
B. CO2�Ĺ̶��У�ÿת��8 mol e-������6 mol����
C. �������л�ѧ��ת��Ϊ����
D. ���������ɵ缫�ĵ缫��ӦʽΪ2Li2CO3+C-4e-�T4Li++3CO2��
���𰸡�A
��������
A. ������ܹ���ˮ��Ӧ�����Һ������LiClO4��DMSO����ˮ�õ���A������
B. ���ݵ缫��Ӧ����ʽ��2Li2CO3=4Li++2CO2��+O2��+4e-��֪���õ�4mole-������2molCO2�����1molO2����ת��8mole-������6mol���壬B��ȷ��
C. ͨ��ͼʾ��֪�����Ӳ��ϵ����������̢��л�ѧ��ת��Ϊ���ܣ�C��ȷ��
D. ͨ��ͼʾ��֪��̼��Ϊ������̼������������Ӧ�����̢���ɵ缫�ĵ缫��ӦʽΪ2Li2CO3+C-4e-�T4Li++3CO2����D��ȷ��
��������������ѡA��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
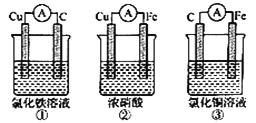
����Ŀ����1��Ϊ����֤Fe2+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ�ĵ���______��д�������ĵ缫��Ӧ________��������ԭ���ʱ�����缫��������ȣ���������ͨ��0.05mol����ʱ�������缫��������Ϊ________��
(2)��CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ��ʾ(A��BΪ���̼��)��

��ʵ����OH-��������B�缫����_____���缫���ͨ����(��A��B)����缫��ӦʽΪ ___________��
�ڵ����ļ�Ժ�����Ϊ33.6L(��״����)ʱ�������ص�����ת����Ϊ80%��������ת�Ƶ��ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ô��м����ⶨ��Ȫʵ���е�ѹǿ�仯����ʶ��Ȫʵ���ԭ��������˵����ȷ����

A. ��ȡ����ʱ��ƿ�еĹ��峣��CaO��CaCl2
B. ��ʪ�����ɫʯ����ֽ��������ƿ�ڣ���ֽ��죬˵��NH3�Ѿ�����
C. �ر�a����������(��������ˮ�Ľ�ͷ�ι�)��������c����b�������Ȫʵ�飬���Ի�������ƿ��ѹǿ�仯������ͼ2����E��ʱ��Ȫ�����
D. ��ҵ�ϣ�������Һ��й©����ϡ���������NaHCO3��Һ����Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±����ֶ�����Ԫ����Ϣ���ж�����������ȷ������ ��

A. �⻯��ķе�ΪH2T��H2R B. ������ϡ���ᷴӦ�ľ��ҳ̶�L��Q
C. M��T�γɵĻ������������ D. L2+��R2���ĺ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����Ͷ�������Ĵ������ϵͳ���ŵ�ǰ����Ĥ�����ĵ����ΪNa2S2��NaBr3���ŵ��ֱ��ΪNa2S4��NaBr������������ȷ����

A. �ŵ�ʱ��������ӦΪ3NaBr-2e-==NaBr3+2Na+
B. ���ʱ��������ӦΪ2Na2S2-2e-== Na2S4+2Na+
C. �ŵ�ʱ��Na+�������ӽ���Ĥ����b������a��
D. �øõ�ص�ⱥ��ʳ��ˮ������2.24LH2ʱ��b������17.40g Na2S4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��һԪǿ��HA��Һ�м���һ�ּ�MOH����Һ�����ԣ������ж���ȷ����
A.����ļ����
B.��Ӧ����Һ��c��A������c��M����
C.���ǰ����������ʵ����ʵ������
D.���ɵ��η���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С����ʵ�����ö������̺�Ũ���Ṳ���Ʊ��������������������ʵ��о���
��1����С��ͬѧ������ͼ��ʾ�������Լ��Ʊ����ռ������������������
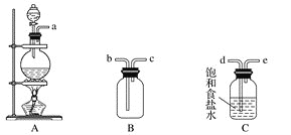
���ò�����������________�����д��ĸ��
�ڽ����������Ⱥ�˳������������Ӧ���ǣ�___________(�õ��ܿڴ�����ĸ��ʾ)��
��Ũ������������̷�Ӧ�����ӷ���ʽ_____________
�� C������___________��D������_______��E�е���©����������_________
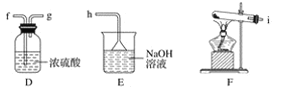
��2����С��ͬѧ���������ʾװ��̽�������������ԡ�
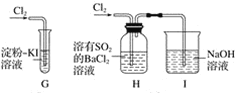
�� ͨ����Cl2ʱ��G�е�������_______��ԭ����_________���û�ѧ����ʽ��ʾ��
�� H�������__________________��
�� �ձ���NaOH��Һ��������______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ����Ҫ100 mL��1 mol/L��Na2CO3��Һ����ͨ�����²������ƣ�
���ѳ����õĹ���Na2CO3����С�ձ��У�����������ˮ�ܽ⡣Ϊ�ӿ��ܽ�����ò��������裻
������������Һ��ȴ�����º�С��ת�뵽����ƿ��
������������ˮ��Һ�����̶���1��2cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ����͵���̶������У�
������������ˮϴ�Ӳ��������ձ�2��3�Σ�ÿ��ϴ�ӵ���Һ��С��ת������ƿ��������ҡ�ȣ�
��������ƿ���������ҡ�ȡ�
��1������������ȷ��˳���ǣ�����ţ����٢� ��
��2����û�в���������������Һ��Ũ�Ȼ� ������ƫ��������ƫ��������
��3����������Һ���ܶ�Ϊ1��06 g/mL�������Һ����������Ϊ ��
��4��������100 mL��1 mol/L��Na2CO3��Һʱ�����в����е� �ᵼ�½��ƫ�ͣ����������д��
����������ƽ����ʱ�����������
�����ձ��е���Һת�Ƶ�����ƿʱ������������ƿ��
������ʱ���ӿ̶���
������ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯��
(1)ʵ���з��֣���Ӧ����е��¶����ߣ����е��¶Ƚ��ͣ��ɴ��ж�����������ķ�Ӧ��______�ȷ�Ӧ�� Ba(OH)28H2O��NH4Cl��Ӧʱ����Ҫ��������ϸ��Ŀ����________________����Ӧ����______ (����������������)�������仯����ͼ��ʾ��

(2)Ϊ����֤Fe3+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ����_________(�����)��

(3)��CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ��ʾ(a��bΪ���̼��)����____(��A��B)���缫���ͨ���飬��缫��ӦʽΪ_____________________ �������ı���¼���33.6Lʱ����������ת����Ϊ90%��������ת�Ƶ��ӵ����ʵ���Ϊ_________mol��

(4)��ͼ��ij��ѧ��ȤС��̽����ͬ�����»�ѧ��ת��Ϊ���ܵ�װ�ã���ش��������⣺

�ٵ��缫cΪAl���缫dΪCu���������ҺΪϡ����ʱ��д����ԭ��������ĵ缫��ӦʽΪ_______________��
�ڵ��缫cΪAl���缫dΪMg���������ҺΪ����������Һʱ����ԭ��ص�����Ϊ_______����ԭ��صĸ�����ӦʽΪ_____________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com