
【题目】对于溶液的酸碱性说法正确的是
A.含OH-的溶液一定呈碱性B.在100°C时,纯水的pH<7,因此显酸性
C.c(H+)=c(OH-)的溶液一定呈中性D.pH=14的溶液碱性最强
【答案】C
【解析】
A、水存在电离:H2O![]() H++OH-,有水的存在时,溶液中一定存在OH-,但溶液不一定是碱性,溶液呈碱性的判断依据是c(OH-)>c(H+),故A错误;
H++OH-,有水的存在时,溶液中一定存在OH-,但溶液不一定是碱性,溶液呈碱性的判断依据是c(OH-)>c(H+),故A错误;
B、在100℃时,纯水中存在c(OH-)=c(H+),仍然呈中性,其pH=6,故B错误;
C、任何水溶液中只要存在c(OH-)=c(H+),则该溶液一定呈中性,故C正确;
D、pH表示溶液酸碱性的适用范围为:c(H+)<1mol/L或c(OH-)<1mol/L,当溶液中c(OH-)或c(H+)大于1mol/L,可直接用c(OH-)或c(H+)表示酸碱性,在25℃下,pH=14的溶液中c(OH-)=1mol/L,其碱性小于c(OH-)>1mol/L的溶液,且用pH表示溶液的碱性时,需要溶液的温度,而题干温度未知,故不能根据pH大小判断溶液酸碱性,故D错误;
故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g) ![]() 2SO3(g) △H< 0。查阅资料知:SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知:SO3熔点16.83℃,沸点44.8℃。
(1)600℃时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3物质的量变化如图。
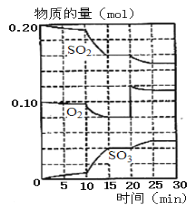
①据图判断,该反应处于平衡状态的时间是_______。
②计算600℃下,该反应的化学平衡常数 K=_______。
③据图判断,反应进行至20 min时,曲线发生变化的原因是________________(用文字表达)。
(2)某化学研究学习小组用下图的装置组装设计了一个实验,以测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。
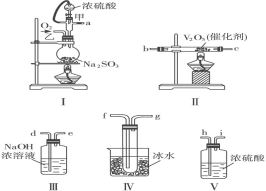
①为提高SO2的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____。
②在Ⅰ处用大火加热烧瓶时SO2的转化率会_______。(选填“增大”“不变”或“减小”)
③用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
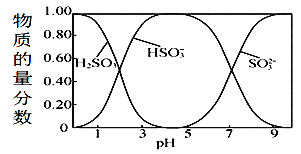
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是__________(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式__________________________________________。
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为__________________(用离子符号表示)。
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为________,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是__________。
(4)D、A、C和碳元素组成的化合物的水溶液呈________性,用离子方程式解释其原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.海产品可用福尔马林浸泡防腐保鲜
C.煤经过气化一液化等物理变化可以转化为清洁燃料
D.粮食酿酒经过了淀粉![]() 葡萄糖
葡萄糖![]() 乙醇的化学变化过程
乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20mL,浓度均为0.1mol/LHCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法正确的是
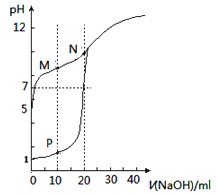
A. M点c(HX)-c(X-)>c(OH-)-c(H+)
B. N点的pH>7的原因是由于NaOH过量所致
C. HX为弱酸,且电离平衡常数Ka≈1×10-10
D. P点c(Cl-)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精,诺卜醇的一种制备方法如图所示。下列说法正确的是( )
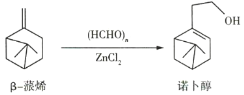
A.可用溴的![]() 溶液区别β-蒎烯与诺卜醇
溶液区别β-蒎烯与诺卜醇
B.β-蒎烯的饱和碳原子上的一氯代物最多有7种
C.β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D.可用酸性高锰酸钾溶液鉴别β-蒎烯和诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
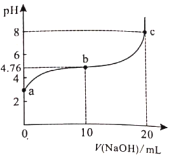
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com