
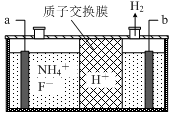
 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.分析 ①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,据此书写化学式;
②由图可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,据此解答即可.
解答 解:①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,故氮化硅的化学式为:Si3N4,故答案为:Si3N4;
②由图可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,氟离子也可能失去电子生成氟单质,故氧化性较强的单质为氟气,故答案为:阳;NH4++3F--6e-=NF3+4H+;F2.
点评 本题主要考查的是电解池反应原理等,注意结合装置图分析判断电极反应及产物,难度不大,注意整理归纳.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
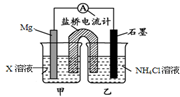
| A. | 盐桥中的K+移向乙烧杯 | |
| B. | 乙烧杯中一直存在:c(Cl-)>c(NH4+) | |
| C. | X可能是CuCl2 | |
| D. | 石墨电极反应式为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 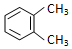 与 与 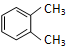 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL溴的四氯化碳溶液,振荡后静置,可观察到液体分层,上层呈橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 相同温度下,测定某物质的量浓度的H2SO4溶液,H3PO4溶液的pH | pH(H2SO4)溶液<pH(H3PO4)溶液 | 非金属性S>P |
| B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有酸性、漂白性 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+、NH3•H2O能大量共存 |
| D | 相同的铝片分别和同体积,同温度且c(H+)相等的盐酸,硫酸发生反应 | 为盐酸反应产生气体的速率快 | 酸性;盐酸>硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
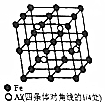 铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: .
. ,C、N、O三种元素的电负性由大到小的顺序为O>N>C.
,C、N、O三种元素的电负性由大到小的顺序为O>N>C.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
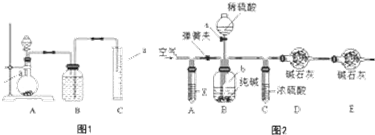
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,乙烯对水果具有催熟功能.
,乙烯对水果具有催熟功能.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
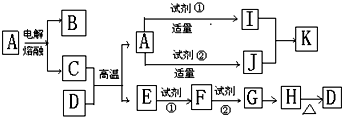
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com