
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂 | |
| C. | Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
分析 A.氯化铁与氨水反应生成氢氧化铁沉淀;
B.碳酸氢钠不稳定,加热或与酸反应都可生成二氧化碳气体;
C.Mg (OH)2分解吸热降低温度,生成氧化镁,氧化镁熔点高;
D.铜与浓硝酸反应,常温下铝与浓硝酸发生钝化.
解答 解:A.在FeCl3饱和溶液中通入足量NH3可得到Fe(OH)3沉淀,得不到胶体,故A错误;
B.碳酸氢钠不稳定,加热或与酸反应都可生成二氧化碳气体,则可用于焙制糕点的膨松剂,但不是和碱反应的原因,故B错误;
C.Mg (OH)2分解吸热降低温度,生成氧化镁,氧化镁熔点高,可用作阻燃剂,故C正确;
D.铜与浓硝酸反应,常温下铝与浓硝酸发生钝化,所以不能用铜罐代替铝罐贮运浓硝酸,故D错误;
故选:C.
点评 本题考查了氢氧化铁胶体的制备、碳酸氢钠、氢氧化镁、氧化镁、浓硝酸的性质,题目难度不大,注意对基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2在反应中得到电子数不一定为NA | |
| B. | 1mol O2在反应中得到电子数一定为4NA | |
| C. | 1molNa2O2与足量H2O反应,转移了NA个电子 | |
| D. | 在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 澄清石灰水与过量苏打溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 碘化亚铁中通入氯气:2I-+Cl2═I2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学为测定0.01mol•L-1盐酸的pH值:用湿的玻璃棒蘸取盐酸,点在pH试纸上 | |
| B. | 乙同学要检验(NH4)2Fe(SO4)2•12H2O晶体中的NH4+:取少量晶体溶于水,加入足量浓NaOH溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| C. | 丙同学为检验Fe3O4中+2价铁元素:先用稀盐酸溶解Fe3O4,再滴加KMnO4溶液 | |
| D. | 丁同学要验证FeCl3与KI反应的限度:可将少量的FeCl3溶液与过量的KI溶液混合,充分反应后用CCl4萃取,静置,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
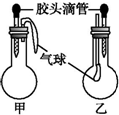 | 甲 | 乙 | |||
| 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| A | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |
| B | NaOH溶液 | 铝 | 硫酸钠溶液 | CO2 | |
| C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 | |
| D | 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO2 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中FeO42-是氧化产物 | |
| C. | 干法中每生成1 molNa2FeO4转移4mol电子 | |
| D. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com